
【题目】引起化学平衡移动的根本原因是( )
A.浓度的改变B.压强的改变
C.使用了催化剂D.正逆反应速率关系的改变
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、F五种物质都含有钠元素,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃性气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可以反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、B、C、D、E、F的化学式:
A________B________C________
D________E________F________
(2)写出F和H反应的化学方程式:______。
(3)写出下列反应的离子方程式:D+盐酸_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年因生锈损失的钢铁,约占世界年产量的十分之一。一种钢铁锈蚀原理示意图如右,下列说法不正确的是

A. 缺氧区:Fe-2e-=== Fe2+
B. 富氧区:O2 + 2H2O + 4e-=== 4OH-
C. Fe失去的电子通过电解质溶液传递给O2
D. 隔绝氧气或电解质溶液均可有效防止铁生锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或叙述正确的是
A. 已知HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3kJ·mol-1
B. 500℃、30 MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热46.2 kJ
2NH3(g) ΔH=-92.4 kJ·mol-1将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热46.2 kJ
C. 已知氢气的燃烧热为286 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=+572 kJ·mol-1
D. 甲烷的燃烧热为890.3 kJ·mol-1,则表示甲烷燃烧热的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1molKClO3放出热量38.8kJ,在MnO2下加热,KClO3的分解分为两步:
①2KClO3+4MnO2![]() 2KCl+2Mn2O7 慢
2KCl+2Mn2O7 慢
②2Mn2O7![]() 4MnO2+3O2 快
4MnO2+3O2 快
下列有关说法不正确的是
A. 1molKClO3所具有的总能量高于1molKCl所具有的总能量
B. 1gKClO3 ,1gMnO2,0.1gMn2O7混合加热,充分反应后MnO2质量仍为1g
C. KClO3分解速率快慢主要取决于反应①
D. 将固体二氧化锰碾碎,可加快KClO3的分解速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入气体X、Y、Z,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是

A. 该反应的化学方程式为2X+Y![]() 2Z
2Z
B. 反应开始至2min时,Z的平均反应速率为0.1 mol·L-1·min-1
C. 该反应为可逆反应
D. 4min时,X、Z的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:

己知:甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25°C和95℃下溶解度分别为0.3g和6.9g。
i制备产品:将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。
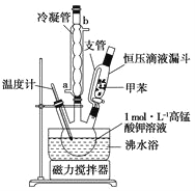
(1)图中冷凝管的进水口为________(填“a”或“b”)。支管的作用是___________。
(2)在本实验中,三颈烧瓶最合适的容积__________(填字母)。
A. 50mL B. I00mL C. 200mL D. 250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是___________________。
ii分离产品:该同学设计如下流程分离粗产品苯甲酸和回收甲苯

(3)操作Ⅰ的名称是___________;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是______________。
iii纯度测定
(4)称取1.220g产品,配成100mL甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH溶滴定(与苯甲酸恰好完全反应)。重复三次,平均每次消耗KOH溶液的体积24.00mL。样品中苯甲酸纯度为______________。
(5)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物,应采用___________法对样品提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如下:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH = –511kJmol-1

可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,须提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a管的作用是________。
(2)A中反应的离子方程式是________。
(3)D的作用是________。
(4)E中冷却水的作用是________。
(5)尾气处理时,可选用的装置是________(填序号)。

(6)锡粒中含铜杂质致E中产生CuCl2,但不影响F中产品的纯度,原因是________。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有________(填序号)。
A.蒸馏烧瓶 B.温度计 C.接收器 D.冷凝管 E.吸滤瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com