
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:

己知:甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25°C和95℃下溶解度分别为0.3g和6.9g。
i制备产品:将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。
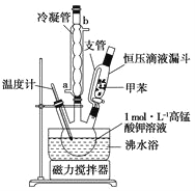
(1)图中冷凝管的进水口为________(填“a”或“b”)。支管的作用是___________。
(2)在本实验中,三颈烧瓶最合适的容积__________(填字母)。
A. 50mL B. I00mL C. 200mL D. 250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是___________________。
ii分离产品:该同学设计如下流程分离粗产品苯甲酸和回收甲苯

(3)操作Ⅰ的名称是___________;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是______________。
iii纯度测定
(4)称取1.220g产品,配成100mL甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH溶滴定(与苯甲酸恰好完全反应)。重复三次,平均每次消耗KOH溶液的体积24.00mL。样品中苯甲酸纯度为______________。
(5)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物,应采用___________法对样品提纯。
【答案】a 平衡压强,使甲苯顺利滴入三颈烧瓶 B 便于控制温度和使容器受热均匀 分液 蒸馏 96% 重结晶
【解析】
(1)根据逆流的冷却的效率高的原理可知,进水口应在冷凝管的下方a处,支管连接了恒压滴液漏斗中的液体上、下方,使恒压滴液漏斗中的液体上、下方的压强相等,便于甲苯顺利滴入三颈烧瓶;综上所述,本题答案是: a ,平衡压强,使甲苯顺利滴入三颈烧瓶。
(2)本实验中用到的液体体积约为55mL,所以选择100mL的三颈烧瓶,故选B,沸水浴加热便于控制温度和使容器受热均匀;综上所述,本题答案是:B,便于控制温度和使容器受热均匀。
(3)一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按流程分离出苯甲酸和回收未反应的甲苯;所以操作Ⅰ是分离出有机相甲苯,用分液方法得到;操作Ⅱ是蒸馏的方法控制甲苯沸点得到纯净的甲苯液体;综上所述,本题答案是:分液, 蒸馏。
(4)苯甲酸纯度=苯甲酸的质量/样品的质量×100%=(2.4×103mol×4×122g/mol)/1.22g×100%=96%。综上所述,本题答案是:96%。
(5)由题给信息可知,苯甲酸的熔点为122.4℃,在25°C和95℃下溶解度分别为0.3g和6.9g;而氯化钾溶解度随温度变化较大,因此提纯苯甲酸与KCl的混合物,应采用重结晶法。综上所述,本题答案是:重结晶。


科目:高中化学 来源: 题型:
【题目】为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
(1)该反应中,氧化剂是________,氧化产物是_____。
(2)当有3mol I2生成时,有______mol还原剂被氧化。
(3)当有1mol氧化剂参与反应时,转移电子的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PEI [ ]是一种非结晶性塑料。其合成路线如下(某些反应条件和试剂已略去):
]是一种非结晶性塑料。其合成路线如下(某些反应条件和试剂已略去):

已知:
(1)A为链状烃。A的化学名称为______。
(2)A→B的反应类型为______。
(3)下列关于D的说法中正确的是______(填字母)。
a.不存在碳碳双键
b.可作聚合物的单体
c.常温下能与水混溶
(4)F由4-氯-1,2-二甲苯催化氧化制得。F所含官能团有-Cl和______。
(5)C的核磁共振氢谱中,只有一个吸收峰。仅以2-溴丙烷为有机原料,选用必要的无机试剂也能合成C写出有关化学方程式:______。
(6)F→K 的反应过程中有多种副产物。其中一种含有3个环的有机物的结构简式是___。
(7)以E和K为原料合成PEI分为三步反应。

写出中间产物1、中间产物2的结构简式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计用50 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1氢氧化钠溶液在如图装置中进行中和反应。试回答下列问题:
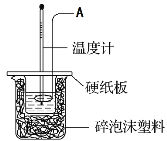
(1)仪器A的名称__________________________
(2)实验过程中下列操作正确是______________(填字母)。
A.用温度计小心搅拌
B.分多次加入氢氧化钠溶液
C.只进行一次实验,用所获得的数据计算中和热
D.用套在温度计上的A轻轻地上下搅动
(3)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________ (结果保留一位小数)。
(4)以下操作,会使测得的中和热ΔH发生怎样的变化?(填“偏大”“偏小”或“不变”)。
①量取稀盐酸时俯视量筒读数,测得的中和热ΔH会_______________ 。
②在中和热测定实验中未用水洗涤温度计上的盐酸直接测定碱的温度,测得的中和热ΔH会_______________。
③若用等浓度的醋酸与 NaOH 溶液反应,则测得的中和热ΔH会 __________,其原因是____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以Zn(NH3)42+、Cu(NH3)42+、Cd(NH3)42+、AsCl52-的形式存在。
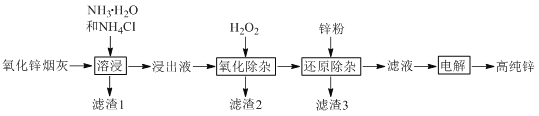
回答下列问题:
(1)Zn(NH3)42+中Zn的化合价为________,“溶浸”中ZnO发生反应的离子方程式为________。
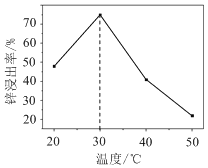
(2)锌浸出率与温度的关系如图所示,分析30 ℃时锌浸出率最高的原因为________。
(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为________。
(4)“滤渣3”的主要成分为________。
(5)“电解”时Zn(NH3)42+在阴极放电的电极反应式为_______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是________(写化学式)。电解后的电解液经补充________(写一种物质的化学式)后可返回“溶浸”工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
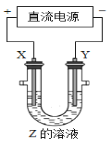
A. 氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠
B. 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C. 电镀工业中,X是待镀金属,Y是镀层金属
D. 外加电流的阴极保护法中,X是待保护金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数值,下列叙述中正确的是
A. 5.6g铁在足量的O2中燃烧,转移的电子数为0.3NA
B. 18g H218O和D2O的混合物中,所含中子数为9NA
C. 1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
D. 0.4 mol NH3与0.6 mol O2在催化剂的作用下充分反应,得到NO的分子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)将过量Mg粉溶于100mL 1.5mol·L-1稀H2SO4中,反应结束后,滤去多余Mg粉,滤液在t℃下蒸发,当滤液质量为72.0g时开始析出MgSO4·xH2O晶体,当析出晶体12.3g时,剩下滤液48.0g。通过计算请回答下列问题(请写出计算过程)。
(1)生成标准状况下的气体体积;
(2)开始析出MgSO4·xH2O晶体时溶液的质量分数;
(3)MgSO4·xH2O中的x值。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com