
【题目】(10分)将过量Mg粉溶于100mL 1.5mol·L-1稀H2SO4中,反应结束后,滤去多余Mg粉,滤液在t℃下蒸发,当滤液质量为72.0g时开始析出MgSO4·xH2O晶体,当析出晶体12.3g时,剩下滤液48.0g。通过计算请回答下列问题(请写出计算过程)。
(1)生成标准状况下的气体体积;
(2)开始析出MgSO4·xH2O晶体时溶液的质量分数;
(3)MgSO4·xH2O中的x值。
【答案】n(H2SO4)=1.5mol/L![]() 0.1L=0.15mol
0.1L=0.15mol
Mg + H2SO4 = MgSO4 + H2↑
1mol 22.4L
0.15mol V(H2)
![]() =
=![]()
解得V(H2)=3.36L
生成标准状况下气体的体积为3.36L
25% 7
【解析】
(1)n(H2SO4)=1.5mol/L![]() 0.1L=0.15mol
0.1L=0.15mol
Mg + H2SO4 = MgSO4 + H2↑
1mol 1mol 22.4L
0.15mol n(MgSO4)V(H2)
![]() =
=![]() =
=![]()
解得n(MgSO4)=0.15mol V(H2)=3.36L
生成标准状况下气体的体积为3.36L
(2)反应生成的m(MgSO4)=0.15mol![]() 120g/mol=18g,当滤液质量为72.0g时开始析出MgSO4·xH2O晶体,MgSO4饱和溶液(开始析出MgSO4·xH2O晶体时)的质量分数为
120g/mol=18g,当滤液质量为72.0g时开始析出MgSO4·xH2O晶体,MgSO4饱和溶液(开始析出MgSO4·xH2O晶体时)的质量分数为![]() 100%=25%
100%=25%
(3)当析出12.3gMgSO4·xH2O晶体时,剩余滤液48.0g;剩余滤液仍为MgSO4饱和溶液,48.0g滤液中MgSO4的质量为48.0g![]() 25%=12.0g;12.3gMgSO4·xH2O晶体中MgSO4的质量为18g-12.0g=6g,n(MgSO4)=
25%=12.0g;12.3gMgSO4·xH2O晶体中MgSO4的质量为18g-12.0g=6g,n(MgSO4)=![]() =0.05mol,n(H2O)=
=0.05mol,n(H2O)=![]() =0.35mol,n(MgSO4):n(H2O)=1:x=0.05mol:0.35mol,x=7。
=0.35mol,n(MgSO4):n(H2O)=1:x=0.05mol:0.35mol,x=7。


科目:高中化学 来源: 题型:
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:

己知:甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25°C和95℃下溶解度分别为0.3g和6.9g。
i制备产品:将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。
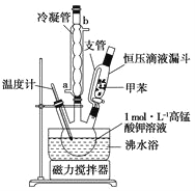
(1)图中冷凝管的进水口为________(填“a”或“b”)。支管的作用是___________。
(2)在本实验中,三颈烧瓶最合适的容积__________(填字母)。
A. 50mL B. I00mL C. 200mL D. 250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是___________________。
ii分离产品:该同学设计如下流程分离粗产品苯甲酸和回收甲苯

(3)操作Ⅰ的名称是___________;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是______________。
iii纯度测定
(4)称取1.220g产品,配成100mL甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH溶滴定(与苯甲酸恰好完全反应)。重复三次,平均每次消耗KOH溶液的体积24.00mL。样品中苯甲酸纯度为______________。
(5)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物,应采用___________法对样品提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如下:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH = –511kJmol-1

可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,须提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a管的作用是________。
(2)A中反应的离子方程式是________。
(3)D的作用是________。
(4)E中冷却水的作用是________。
(5)尾气处理时,可选用的装置是________(填序号)。

(6)锡粒中含铜杂质致E中产生CuCl2,但不影响F中产品的纯度,原因是________。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有________(填序号)。
A.蒸馏烧瓶 B.温度计 C.接收器 D.冷凝管 E.吸滤瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液500mL。根据溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是__________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次)__________。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1cm~2cm处
(3)关于容量瓶的四种叙述:
①是配制准确浓度溶液的仪器
②不宜贮存溶液
③不能用来加热
④使用之前要检查是否漏水
这些叙述中正确的是__________(填字母)。
A.①②③④ B.②③ C.①②④ D.②③④
(4)根据计算用托盘天平称取的NaOH固体质量为______g。固体应放在_______中称量。
(5)下面操作造成所配溶液浓度偏高的是__________(填字母)。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D. 摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=11的X、Y两种碱溶液各10mL,分别稀释至1000mL。其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )

A. X、Y两种碱的物质的量浓度一定相等
B. 稀释后,X溶液碱性比Y溶液碱性强
C. 若9<a<11,则X、Y都是弱碱
D. 完全中和X、Y两溶液时,消耗同浓度盐酸的体积VX>VY
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是
A. 常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA
B. 常温下, pH =12的Na2CO3溶液中含有的OH-离子数为0. 01NA
C. 标准状况下,0.56 L丙烷中含有共价键的数目为0.2 NA
D. 7.8 g Na2O2中含有的阴离子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关石油炼制和煤的利用的说法正确的是( )
A. 煤的气化、液化和干馏是物理变化
B. 通过石油分馏得到的汽油是纯净物
C. 石油裂解是为了得到乙烯、丙烯等气态短链烃
D. 干馏的产物能提取出苯、甲苯等芳香烃,因为煤中含有苯和甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与氢氧化钠溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先 ___________ ,再加入实验药品。接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)若去掉装置B,则导致测定结果 (填“偏高”、“偏低”或“无影响”)。由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见 。
【方案2】按以下步骤测定样品中A1N的纯度:

(4)步骤②生成沉淀的离子方程式为___________________。
(5)步骤③的操作是 。A1N的纯度是 (用m1、m2表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com