
【题目】为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
(1)该反应中,氧化剂是________,氧化产物是_____。
(2)当有3mol I2生成时,有______mol还原剂被氧化。
(3)当有1mol氧化剂参与反应时,转移电子的物质的量为_____mol。
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,反应2A![]() B(g) +C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
B(g) +C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
A. 正反应是吸热反应,且A不是气态
B. 正反应是放热反应,且A是气态
C. 其他条件不变,加入少量A,该平衡向正反应方向移动
D. 改变压强对该平衡的移动无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、F五种物质都含有钠元素,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃性气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可以反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、B、C、D、E、F的化学式:
A________B________C________
D________E________F________
(2)写出F和H反应的化学方程式:______。
(3)写出下列反应的离子方程式:D+盐酸_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定的溶液中一定能大量共存的是
①c(H+)/c(OH- ) = 1×10-10 的溶液中:K+、Na+、CH3COO- 、SO42-
②pH = 13 的溶液中:CO32-、Na+、AlO2- 、Cl-
③由水电离出的 c(H+) = 1×10-12 mol/L 的溶液中:Cl- 、Na+、NO3- 、S2O32-
④使甲基橙变红色的溶液中:Fe3+、NO3 - 、K+、SO42-
A. ①②③ B. ①②④ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,水的离子积常数 Kw = 1×10-13,将此温度下 pH = 11 的 Ba(OH)2溶液 a L 与 pH =1的 H2SO4 溶液 b L 混合(设混合溶液体积为两者之和,固体体积忽略不计)。下列说法不正确的是
A. 若 a∶b = 9∶2,则所得溶液 pH 等于 2
B. 若 a∶b = 9∶2,该混合溶液最多能溶解铁粉 0.28(a + b) g
C. 若所得混合溶液为中性,则 a∶b = 1∶1
D. 若所得混合溶液为中性,生成沉淀的物质的量为 0.05b mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年因生锈损失的钢铁,约占世界年产量的十分之一。一种钢铁锈蚀原理示意图如右,下列说法不正确的是

A. 缺氧区:Fe-2e-=== Fe2+
B. 富氧区:O2 + 2H2O + 4e-=== 4OH-
C. Fe失去的电子通过电解质溶液传递给O2
D. 隔绝氧气或电解质溶液均可有效防止铁生锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或叙述正确的是
A. 已知HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3kJ·mol-1
B. 500℃、30 MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热46.2 kJ
2NH3(g) ΔH=-92.4 kJ·mol-1将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热46.2 kJ
C. 已知氢气的燃烧热为286 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=+572 kJ·mol-1
D. 甲烷的燃烧热为890.3 kJ·mol-1,则表示甲烷燃烧热的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:

己知:甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25°C和95℃下溶解度分别为0.3g和6.9g。
i制备产品:将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。
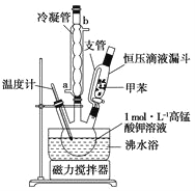
(1)图中冷凝管的进水口为________(填“a”或“b”)。支管的作用是___________。
(2)在本实验中,三颈烧瓶最合适的容积__________(填字母)。
A. 50mL B. I00mL C. 200mL D. 250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是___________________。
ii分离产品:该同学设计如下流程分离粗产品苯甲酸和回收甲苯

(3)操作Ⅰ的名称是___________;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是______________。
iii纯度测定
(4)称取1.220g产品,配成100mL甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH溶滴定(与苯甲酸恰好完全反应)。重复三次,平均每次消耗KOH溶液的体积24.00mL。样品中苯甲酸纯度为______________。
(5)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物,应采用___________法对样品提纯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com