
【题目】下列各组元素按电负性大小排列正确的是
A.F>N>O B.O>Cl>F C.As>P>H D.Cl>S>As
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数。下列说法正确的是( )
A. 7.8 g Na2O2中含有的阴离子数目为0.2NA
B. 标准状况下,2.24 L CHCl3的分子数为0.1NA
C. 1 L 0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA
D. 0.1 mol Fe与足量稀HNO3反应,转移电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法,不正确的是
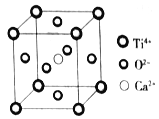
(Ti4+位于顶点上,O2-位于面心上,Ca2+位于中心)
A. 该晶体的化学式为CaTiO3
B. 该晶体中每个Ti4+和8个O2-相紧邻
C. 一个CO2晶胞中平均含有4个CO2分子
D. 金属晶体的熔点可能比分子晶体的熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(7分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
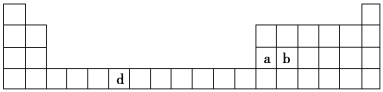
(1)请写出元素d的基态原子电子排布式________________________________________。
(2)b元素的氧化物中b与氧元素之间的共价键类型是________。其中b原子的杂化方式是_______。
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
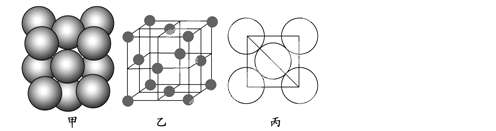
若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为M,则一个晶胞中a原子的数目为________,该晶体的密度为________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于烷烃性质的叙述,错误的是
A. 烷烃不能使酸性高锰酸钾溶液褪色
B. C20H42一定属于烷烃
C. 烷烃在水中的溶解度随着碳原子数的增加而增大
D. 烷烃都能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H=a kJ/mol(a >0),下列有关该反应的说法正确的是( )
Fe(s)+CO2(g) △H=a kJ/mol(a >0),下列有关该反应的说法正确的是( )
A. 若生成1 mol Fe,则吸收的热量小于a kJ
B. 若升高温度,正反应速率加快,逆反应速率加快,则化学平衡正向移动
C. 若增大压强反应向正反应方向进行
D. 若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南方的水果大量向北方销售,运输这些水果时,常常将浸有高锰酸钾溶液的硅藻土放置在盛放水果的集装箱中,高锰酸钾溶液的作用是( )
A. 吸收水果产生的乙烯,防止水果早熟B. 吸收水果周围的氧气,防止水果腐烂
C. 杀死水果周围的细菌,防止水果霉变D. 产生氧化性,催熟水果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 光导纤维的主要成分是硅
B. 利用盐酸刻蚀石英制作艺术品
C. 水晶项链是硅单质制品
D. 硅酸钠是制备木材防火剂的原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com