
Ⅰ.将由Na+、Ba2+、Cu2+、SO42-、Cl-组合形成的三种强电解质溶液,分别装入下图装置中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液pH与电解时间t的关系如右上图(忽略因气体溶解带来的影响)。据此回答下列问题:

(1)在甲中烧杯中滴加酚酞, 极(填a或b)附近溶液会变红。
(2)写出乙烧杯中发生反应的化学方程式 。
(3)电极f上发生的电极反应式为 。
(4)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是 。
Ⅱ.工业上利用BaSO4制备BaCl2的工艺流程如下:
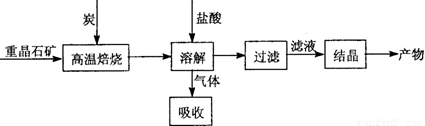
某活动小组的同学在实验室以重晶石(主要成分BaSO4)为原料,对上述工艺流程进行模拟实验。
(1)上述过程中,气体用过量NaOH溶液吸收得到Na2S。Na2S水溶液显碱性的原因是 。(用离子方程式表示)
(2)已知有关反应的热化学方程式如下:
BaSO4(s) +4C(s) 4CO(g)+BaS(s)
△H1 =
+571.2kJ/mol ①
4CO(g)+BaS(s)
△H1 =
+571.2kJ/mol ①
C(s) +CO2(g) 2CO(g)
△H2 =
+172.5kJ/mol
②
2CO(g)
△H2 =
+172.5kJ/mol
②
则反应BaSO4(s)
+2C(s) 2CO2(g)
+ BaS(s) △H3 =
2CO2(g)
+ BaS(s) △H3 =
(3)在高温焙烧重晶石过程中必须加入过量的炭,同时还要通入空气,其目的是 。
【解析】
试题分析:Ⅰ在电解时乙中c电极质量增加,说明c电极为阴极,则直流电源M极为负极,N极为正极。由于开始时溶液的PH值甲、丙是7,二者应为强酸强碱盐;乙的PH小于7,为强酸弱碱盐,结合已知条件,含Cu2+。(1)随着电解的进行,甲的PH逐渐增大,说明H2O和电解质都发生了反应,甲为氯化物。H+在阴极a电极放电,由于破坏了附近的水的电离平衡,其附近的OH-浓度增大,所以滴加酚酞a电极附近会变红,Cl-在阳极b放电(2);乙的PH逐渐减小,说明OH-放电,含有含氧酸根离子SO42-、乙是CuSO4溶液.乙烧杯的化学方程式是: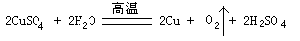
(3)丙在电解过程中PH不变,一直是7,说明丙为活泼金属的含氧酸盐,电解的实质是水,丙为Na2SO4溶液.在f极OH-放电,电极反应式为:4OH-—4e-=O2↑+2H2O。(4)根据电解方程式可知要使丙烧杯中溶液恢复到原来的状态,应加入两电极的产物反应得到的物质即可,即加入CuO,其质量为10克。
Ⅱ(1)Na2S是强碱弱酸盐, S2-水解消耗水电离产生的H+,最终整个溶液中c(OH-)〉c(H+),呈碱性,离子方程式为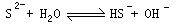
(2)、①-②×2得:该反应方程式,△H3=△H1-2△H2=+571.2 kJ/mol-2×172.5 kJ/mol=+226.2 kJ/mol.
(3)该反应为吸热反应,碳燃烧放热可为反应提供能量,所以要加入过量的炭,并且要不断通入空气。
考点:考查盐的电解、盐的水解、反应热等知识。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 回答下列各小题:
回答下列各小题:| O | 2- 4 |
| O | 2- 4 |
| H | + 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是( )
水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是( )| A、纯水中25°C时的,c(H+)比100℃的时c(H+)大 | B、100℃时某溶液中由水电离产生的c(H+)═1×10-11mol?L-1,则该溶液的Ph可能是11或3 | C、将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10:1 | D、25℃时,某Na2SO4溶液中c(SO 42-)=5.0×10-4mol/L则溶液中c(Na+):c(OH-)为104:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com