



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
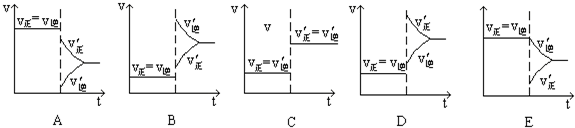
科目:高中化学 来源: 题型:阅读理解
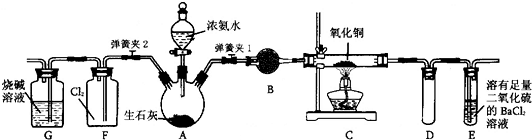
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:巢湖市一中2008-2009学年度第二学期第一次月考高二化学试卷 题型:022
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.分析图中信息,回答下列问题:
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:________.
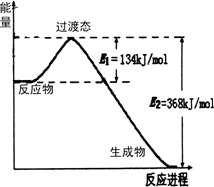
(2)如图表示的是:N2+3H2=2NH3的能量变化情况,写出该反应生成液态氨的热化学方程式:________.
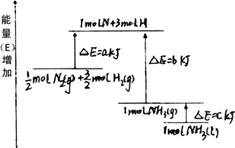
(3)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据).根据如图回答下列问题:
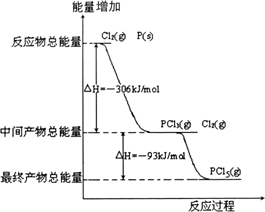
①P和Cl2反应生成PCl3的热化学方程式________.PCl5分解成PCl3和Cl2的热化学方程式________,
②P和Cl2分两步反应生成1 mol PCl5的ΔH3=________,P和Cl2一步反应生成1 mol PCl5的ΔH4________ΔH3(填“大于”、“小于”或“等于”).
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com