
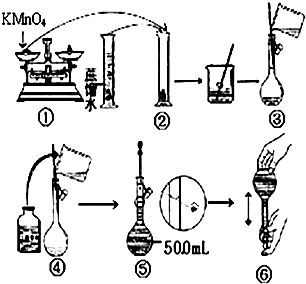
 人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:分析 (1)根据配制一定物质的量浓度的溶液的正确操作结合图示分析解答;
(2)依据容量瓶的用途解答;依据仰视刻度线,会使溶液体积偏大判断,结合C=$\frac{n}{V}$分析;
(3)碱式滴定管能够量取碱性和非氧化性液体,酸性滴定管可以量取酸性和氧化性液体;草酸具有还原性,能够使高锰酸钾褪色;
(4)草酸跟酸性KMnO4溶液反应生成二氧化碳、二价锰离子等,结合氧化还原反应得失电子守恒写出化学方程式;
(5)根据滴定数据及钙离子与高锰酸钾的关系式计算出血液样品中Ca2+的浓度.
解答 解:(1)量筒为精密仪器,不能在量筒中溶解固体,故②错误,定容时应平视刻度线,至溶液凹液面与刻度线相切,⑤错误;
故选:②⑤;
(2)容量瓶是专门用来配制一定浓度溶液的精密仪器;如果用图示的操作配制溶液,由于仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小;
故答案为:偏小;
(3)酸性高锰酸钾具有强的氧化性,应盛放在酸式滴定管内;草酸具有还原性,能够使高锰酸钾褪色,向无色草酸中加入酸性高锰酸钾,当草酸反应完后,滴入最后一滴标准溶液使溶液由无色变为紫红色,且半分钟内无变化,滴定到达终点;
故答案为:酸式滴定管;滴入最后一滴标准溶液使溶液由无色变为紫红色,且半分钟内无变化;
(4)草酸跟酸性KMnO4溶液反应,离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O;
故答案为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O;
(5)血样20.00mL经过上述处理后得到草酸,草酸消耗的消耗的高锰酸钾的物质的量为:0.020mol/L×0.012L=2.4×10-4mol,根据反应方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,及草酸钙的化学式CaC2O4,可知:n(Ca2+)=n(H2C2O4)=$\frac{5}{2}$n(MnO4-)=2.5×2.4×10-4mol=6×10-4mol,
Ca2+的质量为:40g/mol×6×10-4mol=0.024g,钙离子的浓度为:$\frac{0.024g}{20c{m}^{3}}$=0.0012g/cm3=1.2 mg/cm3,
故答案为:1.2.
点评 本题考查了配制一定物质的量浓度的方法及误差分析,氧化还原滴定,明确配置一定物质的量浓度原理和操作步骤、明确氧化还原滴定原理和操作是解题关键,侧重考查学生对实验基本知识的掌握情况,题目难度中等.


科目:高中化学 来源: 题型:解答题
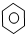 ③CH3CH2Cl ④CH3COOH ⑤聚乙烯五种物质中:
③CH3CH2Cl ④CH3COOH ⑤聚乙烯五种物质中:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | “臭氧空洞”“温室效应”“光化学烟雾”“硝酸型酸雨”的形成过程都与氮氧化合物有关 | |
| B. | 石油裂解、煤的气化、海水制镁、石油中提取石蜡等过程中都包含化学变化 | |
| C. | 低碳经济就是以低耗能、低污染、低排放为基础的经济发展模式 | |
| D. | 可利用丁达尔效应鉴别氢氧化铁胶体和氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
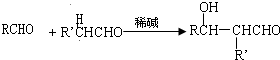
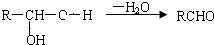
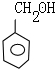 ,E
,E .
. .
.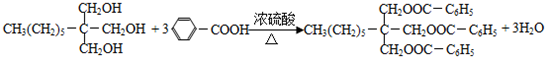 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | CO | C. | CH3OH | D. | C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LCCl4中含有的分子数目为0.5NA | |
| B. | 常温下,1L0.1mol/LCH3COOH溶液中含有的H+数目为0.1NA | |
| C. | 25℃,PH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| D. | 1L 1mol/L的NH4Cl溶液中,所含NH4+的数目小于NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com