
卤代烃跟NaOH水溶液发生取代反应:实质是带负电的OH-取代了卤原子:CH3CH2CH2Br+OH-→CH3CH2CH2OH+Br-则下列反应方程式正确的是( )
A.CH3CH2Br+HS-→CH3CH2HS+Br-
B.CH3CH2I+HS-→CH3CH2HS+I-
C.CH3Cl+CH3CH2S-→CH3SCH2CH3+Cl-
D.CH3Cl+HS-→CH3S-+HCl
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:
按要求填空:
(1)某溶液中只含有K+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑,回答下列问题:
①该反应中的氧化剂是_______________。
②用单线桥表示此反应转移的电子数目及方向。
___________________________________________________________________________
③若氧化产物比还原产物多1.75 mol,上述反应转移的电子数目为 。
(3)镁、铝合金3 g与100 mL稀H2SO4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4 g,则原硫酸溶液的物质的量浓度为
查看答案和解析>>
科目:高中化学 来源: 题型:
将淀粉水解,并用新制的氢氧化铜悬浊液检验其水解产物的实验中,要进行的主要操作是
①加热 ②滴入稀硫酸 ③加入新制的氢氧化铜悬浊液 ④加入足量的氢氧化钠溶液.
A.①→②→③→④→① B.②→①→④→③→①
C.②→④→①→③→① D.③→④→①→②→①
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验的操作和所用的试剂都正确的是( )
A.要鉴别己烯中是否混有少量甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液
B.配制浓硫酸和浓硝酸的混酸时,将浓硝酸沿壁缓缓倒入到浓硫酸中
C.除去溴苯中少量的溴,可以加水后分液
D.制硝基 苯时,将盛有混合液的试管直接在酒精灯火焰上加热。
苯时,将盛有混合液的试管直接在酒精灯火焰上加热。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
HX + 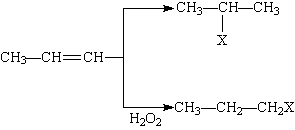 (X为卤素原子)
(X为卤素原子)
工业上利用上述信息,按下列路线合成结构简式为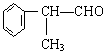 的物质,该物质是一种香料。
的物质,该物质是一种香料。
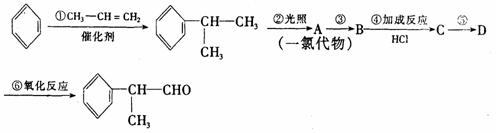
请根据上述路线,回答下列问题:
(1)A的结构简式可能为____________________________________。
(2)反应①、③、⑤的反应类型分别为________、________、_______。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
_________________________________________________________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是_______________________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):
_____________________________,_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐
B.已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数为1×10-7,则该酸的电离度约为0.01%
C.0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液等体积混合,则溶液中:
2c(H+) + c(CH3COOH) = 2 c(OH-) + c(CH3COO-)
D.在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,但Ksp不会发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 1mol任何气体所占体积都约为22.4L |
|
| B. | 1molH2O在标准状况下体积为22.4L |
|
| C. | 1mol气体体积为22.4L,则一定是标准状况 |
|
| D. | 气体摩尔体积不一定是22.4L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
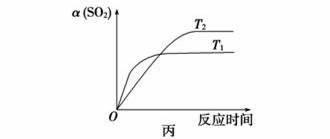
已知反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
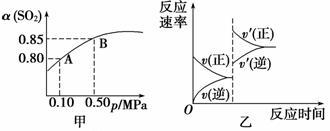
A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1
B.由图甲知,B点SO2、O2、SO3 的平衡浓度之比为2∶1∶2
的平衡浓度之比为2∶1∶2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com