
【题目】元素周期表中第ⅦA族包括氟、氯、溴、碘、砹五种元素,统称为卤素。其中代表元素氯富集在海水中,其单质及其化合物在生活、生产中有着广泛地应用。回答下列问题:
(1)基态氯原子能量最高能层上的原子轨道数为______;现代化学中,常用光谱分析来鉴定元素,这与原子的___________有关。
(2)物质的熔点与其结构密切相关。某同学判断某些卤化物的熔点为NaF>NaCl,SiF4<SiCl4。该同学的主要判断依据是___________。
(3)在氢卤酸中,HF是唯一的弱酸,主要原因是__________。
(4)光气(![]() )用作有机合成、农药、药物、染料及其他化工制品的中间体。从电子云的重叠角度分析,该分子中含有的共价键类型是_______,C原子的杂化方式为____,分子的空间构型为______。
)用作有机合成、农药、药物、染料及其他化工制品的中间体。从电子云的重叠角度分析,该分子中含有的共价键类型是_______,C原子的杂化方式为____,分子的空间构型为______。
(5)PtCl2(NH3)2为平面结构,可以形成甲、乙两种固体。其中,一种为淡黄色固体,在水中溶解度小;另一种为棕黄色固体,在水中溶解度大,是癌症治疗的常用化学药物。
① 棕黄色固体是图中的___(填“甲”或“乙”),试解释它在水中的溶解度比淡黄色固体大的原因是___。

② Pt原子在三维空间里可按图 所示方式堆积形成金属Pt晶体:
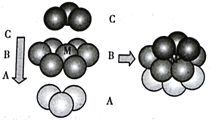
该晶胞的堆积方式为____,M 原子的配位数为________,若该晶体的密度为ρg·cm3,阿伏加德罗常数的值为NA,则Pt原子的原子半径为______pm。
【答案】 9 核外电子发生跃迁 NaF中的离子键键能高于NaCl,故熔、沸点更高,SiF4的分子间作用力小于SiCl4,故熔、沸点更低 HF分子间因氢键而形成(HF)n,HF分子与H2O分子间也存在氢键,导致HF在水溶液中不易电离 σ键、π键 sp2杂化 平面三角形 甲 甲是极性分子,乙是非极性分子,水是极性溶剂,根据相似相溶原理,极性分子甲更易溶于水 面心立方 12 
【解析】
(1)基态氯原子的电子排布式为1s22s22p63s23p5,能量最高能层为第3能层,第3能层上的原子轨道数为9;现代化学中,常用光谱分析来鉴定元素,这与原子的核外电子发生跃迁有关,故答案为:9;核外电子发生跃迁;
(2)NaF和NaCl属于离子晶体,氟离子半径比氯离子半径小,NaF中的离子键键能比NaCl高,故熔、沸点更高;SiF4和SiCl4是分子晶体,SiF4的相对分子质量小于SiCl4,使得SiF4的分子间作用力小于SiCl4,故熔、沸点更低,故答案为:NaF中的离子键键能高于NaCl,故熔、沸点更高,SiF4的分子间作用力小于SiCl4,故熔、沸点更低;
(3)HF分子间因氢键而形成(HF)n,HF分子与H2O分子间也存在氢键,导致HF在水溶液中不易电离,因此HF是弱酸,故答案为:HF分子间因氢键而形成(HF)n,HF分子与H2O分子间也存在氢键,导致HF在水溶液中不易电离;
(4)光气(![]() )中含有的共价键有C-Clσ键、C=O中含有σ键和π键,C原子上连接有3个原子,没有孤电子对,杂化方式为sp2,分子的空间构型为平面三角形,故答案为:σ键、π键;sp2杂化;平面三角形;
)中含有的共价键有C-Clσ键、C=O中含有σ键和π键,C原子上连接有3个原子,没有孤电子对,杂化方式为sp2,分子的空间构型为平面三角形,故答案为:σ键、π键;sp2杂化;平面三角形;
(5)①Pt(NH3)2Cl2分子是平面结构,两个Cl原子有相邻和相对两种位置,水是极性分子,一种为淡黄色,在水中的溶解度小,则为非极性分子,NH3和Cl分别对称分布在四边形的4个角上,正负电荷重心重合,故淡黄色的为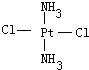 ,另一种为棕黄色,在水中的溶解度较大,则为极性分子,NH3和Cl在四边形的4个角上的分布是不对称的,即正负电荷重心不重合,故棕黄色的是
,另一种为棕黄色,在水中的溶解度较大,则为极性分子,NH3和Cl在四边形的4个角上的分布是不对称的,即正负电荷重心不重合,故棕黄色的是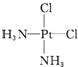 ,故答案为:甲;甲是极性分子,乙是非极性分子,水是极性溶剂,根据相似相溶原理,极性分子甲更易溶于水;
,故答案为:甲;甲是极性分子,乙是非极性分子,水是极性溶剂,根据相似相溶原理,极性分子甲更易溶于水;
② 根据图示, Pt晶体的晶胞的堆积方式为面心立方,M周围12个原子到M的距离相等且最小,M 原子的配位数为12,设Pt原子的原子半径为x cm,则晶胞的边长2![]() x cm,1个晶胞中含有Pt原子数=8×
x cm,1个晶胞中含有Pt原子数=8×![]() +6×
+6×![]() =4,1mol晶胞的质量为4×195g,1mol晶胞的体积为NA(2
=4,1mol晶胞的质量为4×195g,1mol晶胞的体积为NA(2![]() x)3 cm3,则
x)3 cm3,则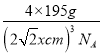 =ρg·cm3,解得x=
=ρg·cm3,解得x=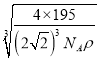 cm =
cm =![]() ×
×![]() ×1010pm,故答案为:面心立方;12 ;
×1010pm,故答案为:面心立方;12 ; ![]() ×
×![]() ×1010。
×1010。


科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)![]() 2C(g) ΔH<0,4 s后反应达到平衡状态,此时测得C的浓度为0.6mol/L,下列说法中正确的是
2C(g) ΔH<0,4 s后反应达到平衡状态,此时测得C的浓度为0.6mol/L,下列说法中正确的是
A. 当A、B、C的物质的量浓度之比为2∶1∶2时,反应即达到平衡状态
B. 达平衡后若升高温度,正反应速率降低
C. 此时A的转化率为50%
D. 4 s内用物质B表示的反应速率为0.075 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《本草纲目》记载: “生熟铜皆有青,即是铜之精华,大者即空绿,以次空青也。铜青则是铜器上绿色者,淘洗用之。 ”这里的“铜青”是指
A. CuO B. Cu2O C. CuSO4 D. Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将一定质量的混合气体在密闭容器中发生反应aA(g) + bB(g) ![]() cC(g) + dD(g),达到平衡时测得B气体的浓度为0.6mol/l,恒温下将密闭容器的容积扩大一倍,重新达到平衡时,测得B气体的浓度为 0.4mol/l,下列叙述中正确的是( )
cC(g) + dD(g),达到平衡时测得B气体的浓度为0.6mol/l,恒温下将密闭容器的容积扩大一倍,重新达到平衡时,测得B气体的浓度为 0.4mol/l,下列叙述中正确的是( )
A. a+b>c+d
B. 平衡向右移动
C. 重新达平衡时,A气体浓度增大
D. 重新达平衡时,B的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为浓硫酸与铜片反应的装置。

请回答:
(1)浓硫酸与铜片反应的化学方程式为 。
(2)反应一段时间后,试管乙中品红溶液的现象是 。
(3)下列有关该实验的说法中,不正确的是 。
A.该反应中浓硫酸只体现酸性 |
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染 |
C.反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯,溶液显蓝色 |
D.含0.04mol溶质的浓硫酸与足量的铜片反应,能收集到448mL的SO2(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关,下列有关说法正确的是()
A. 糖类、油脂、蛋白质都可发生水解
B. 油脂可用于制备肥皂和甘油
C. 水玻璃是制备木材防火剂的原料,其主要成分是二氧化硅
D. 石油是复杂的混合物,通过分馏可以获得汽油、煤油等,通过催化重整可以获得乙烯、丙烯等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如下图所示,下列说法不正确的是( )

A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率如下,其中反应速率最大的是( )
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率如下,其中反应速率最大的是( )
A. v(A)=0.15 mol·L-1·min-1 B. v(B)=0.6 mol·L-1·min-1
C. v(C)=0.04 mol·L-1·s-1 D. v(D)=0.01 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com