
【题目】在一定温度下,将一定质量的混合气体在密闭容器中发生反应aA(g) + bB(g) ![]() cC(g) + dD(g),达到平衡时测得B气体的浓度为0.6mol/l,恒温下将密闭容器的容积扩大一倍,重新达到平衡时,测得B气体的浓度为 0.4mol/l,下列叙述中正确的是( )
cC(g) + dD(g),达到平衡时测得B气体的浓度为0.6mol/l,恒温下将密闭容器的容积扩大一倍,重新达到平衡时,测得B气体的浓度为 0.4mol/l,下列叙述中正确的是( )
A. a+b>c+d
B. 平衡向右移动
C. 重新达平衡时,A气体浓度增大
D. 重新达平衡时,B的体积分数减小
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作和数据记录都正确的是( )
A. 用托盘天平称量时,将NaOH固体放在右盘内的纸上,称得质量为10.2 g
B. 用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.30 mL
C. 用干燥的广泛pH试纸测稀盐酸的pH=5.1
D. 用10 mL量筒量取NaCl溶液,体积为6.5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图的各方框表示有关的一种反应物或生成物(某些物质己经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
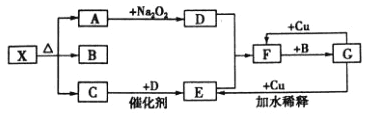
(l)写出下列各物质的化学式:X:_______;F: _______;G: _______。
(2)写出下列变化的反应方程式:
A→D:________________;G→E:________________。
(3)实验室里,常用加热______的混合物的方法制取气体C,常采用______法来收集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
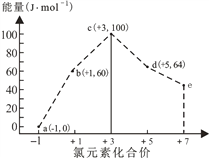
A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为20kJ·mol-1
C. b→a+d反应的热化学方程式为3ClO-(aq)=
ClO3-(aq)+2Cl-(aq) △H=-116kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为16:1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使反应N2+3H2 ![]() 2NH3发生,有关说法正确的是( )
2NH3发生,有关说法正确的是( )
A. 达到化学平衡时,N2将完全转化为NH3
B. 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C. 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D. 达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质](15分)
已知:A、B、C、D四种元素,原子序数依次增大。A是短周期元素中金属性最强的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素。试回答下列有关问题:
(1)写出D元素价电子的电子排布式___________。
(2)D可形成化合物[D(H2O)6](NO3)3。
①[D(H2O)6](NO3)3中阴离子的立体构型是 。NO3中心原子的轨道杂化类型为 。
②在[D(H2O)6]3+中D3+与H2O之间形成的化学键称为____ __,1 mol [D(H2O)6] 3+中含有的σ键有 mol。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中 (填化学式)为非极性分子。另一种物质的电子式为 。
(4)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图以及晶胞的剖面图:

晶胞中距离一个A+最近的C有______个,这些C围成的图形是________;若晶体密度为ρ g·cm3,阿伏加德罗常数的值用NA表示,则A+的离子半径为_______cm(用含NA与ρ的式子表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第ⅦA族包括氟、氯、溴、碘、砹五种元素,统称为卤素。其中代表元素氯富集在海水中,其单质及其化合物在生活、生产中有着广泛地应用。回答下列问题:
(1)基态氯原子能量最高能层上的原子轨道数为______;现代化学中,常用光谱分析来鉴定元素,这与原子的___________有关。
(2)物质的熔点与其结构密切相关。某同学判断某些卤化物的熔点为NaF>NaCl,SiF4<SiCl4。该同学的主要判断依据是___________。
(3)在氢卤酸中,HF是唯一的弱酸,主要原因是__________。
(4)光气(![]() )用作有机合成、农药、药物、染料及其他化工制品的中间体。从电子云的重叠角度分析,该分子中含有的共价键类型是_______,C原子的杂化方式为____,分子的空间构型为______。
)用作有机合成、农药、药物、染料及其他化工制品的中间体。从电子云的重叠角度分析,该分子中含有的共价键类型是_______,C原子的杂化方式为____,分子的空间构型为______。
(5)PtCl2(NH3)2为平面结构,可以形成甲、乙两种固体。其中,一种为淡黄色固体,在水中溶解度小;另一种为棕黄色固体,在水中溶解度大,是癌症治疗的常用化学药物。
① 棕黄色固体是图中的___(填“甲”或“乙”),试解释它在水中的溶解度比淡黄色固体大的原因是___。

② Pt原子在三维空间里可按图 所示方式堆积形成金属Pt晶体:
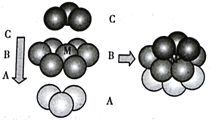
该晶胞的堆积方式为____,M 原子的配位数为________,若该晶体的密度为ρg·cm3,阿伏加德罗常数的值为NA,则Pt原子的原子半径为______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1,该反应是一个可逆反应。若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是( )
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1,该反应是一个可逆反应。若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是( )


A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com