
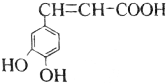
| A. | 与该芳香族化合物分子式相同、官能团种类及数目均相同且苯环上的一氯代物只有两种的有机物的结构有4种(不考虑空间异构) | |
| B. | 咖啡酸只能加聚成高分子化合物 | |
| C. | 咖啡酸最多可与5mol氢气发生加成反应 | |
| D. | 1mol该物质与足量的Na2CO3溶液反应,能消耗3molCO32- |
分析 A.该芳香族化合物有三个取代基,分别为两个酚羟基、一个-CH=CH-COOH,与该分子式相同、官能团种类及数目均相同且苯环上的一氯代物只有两种的有机物,为变换三个官能团在苯环上的位置;
B.羧基和酚羟基可发生缩聚反应;
C.苯环能与氢气加成,但羧基中的羰基不能与氢气加成;
D.1mol酚羟基与足量的Na2CO3溶液反应,能消耗1molCO32-,1mol羧基与足量的Na2CO3溶液反应,能消耗0.5molCO32-.
解答 解:A.该芳香族化合物有三个取代基,分别为两个酚羟基、一个-CH=CH-COOH,与该有机物符合条件的异构体为官能团在苯环上的位置不同,分别为: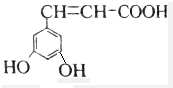 、
、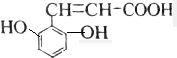 、
、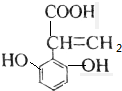 、
、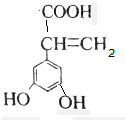 ,共有4种,故A正确;
,共有4种,故A正确;
B.咖啡酸碳碳双键能发生加成反应生成高分子化合物,羧基和酚羟基可发生缩聚反应生成高分子化合物,故B错误;
C.苯环与双键与氢气发生加成反应,则1mol咖啡酸最多可与4mol氢气发生加成反应,故C错误;
D.1mol酚羟基与足量的Na2CO3溶液反应,能消耗1molCO32-,生成酚钠,1mol羧基与足量的Na2CO3溶液反应,能消耗0.5molCO32-,生成二氧化碳,1mol该物质与足量的Na2CO3溶液反应,能消耗2.5molCO32-,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、羧酸、烯烃性质的考查,注意D中酚与羧酸性质的差别,题目难度中等.


科目:高中化学 来源: 题型:选择题
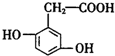 ,则下列说法错误的是( )
,则下列说法错误的是( )| A. | 1mol尿黑酸与足量的浓溴水反应,最多消耗3mol Br2 | |
| B. | 1mol尿黑酸最多能与4mol H2反应 | |
| C. | 尿黑酸分子中在同一平面上的碳原子至少有7个 | |
| D. | 尿黑酸可与碳酸氢钠溶液反应放出CO2,生成2.24LCO2(标况下)需要尿黑酸16.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
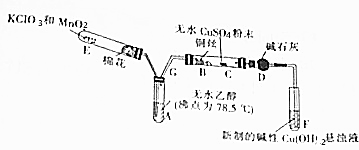
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入少量CH3COONa固体 | B. | 通入少量氯化氢气体 | ||
| C. | 提高温度 | D. | 加入少量纯醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 自来水的体积 | KI溶液的体积 | 消耗的Na2S2O3溶液的体积 |
| 1 | 10.00mL | 10.00mL | 19.96mL |
| 2 | 10.00mL | 10.00mL | 20.04mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
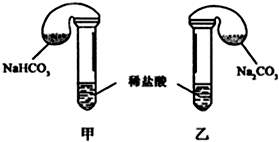
| 试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
| 第 ① 组 | 42g NaHCO3 53g Na2CO3 300mL4mol/L盐酸 | 甲中气球与乙中 气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n (Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 42g NaHCO3 53g Na2CO3 300mL3mol/L盐酸 | 甲中气球体积大于乙中气球的体积(填“大于”或“小于” 或“等于”) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径A>B>D>C | B. | 原子序数a>b>c>d | ||
| C. | 离子半径D>C>B>A | D. | 金属性B>A,非金属性D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com