
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( )
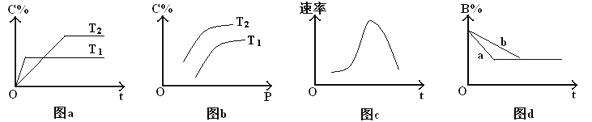
A. 由图a可知,T1>T2,该反应的逆反应为吸热反应
B. 由图b可知,该反应m+n<p
C. 图c是绝热条件下速率和时间的图像,由此说明该反应吸热
D. 图d中,若m+n=p,则曲线a一定增大了压强
【答案】A
【解析】
A. 由图a可知,T1时达到平衡所需时间短,则T1>T2,因温度越高,C%越低,说明升温平衡逆向移动,逆反应为吸热反应,故A正确;
B. 由图b可知,C%随着压强的增大而增大,说明加压后平衡正向移动,正反应为气体分子数目减小的反应,则该反应m+n>p,故B错误;
C.由图c可知,随着反应的时行,反应的速率先增大后减小,说明开始由于反应放热导致温度升高,此时温度对化学反应速率的影响较大,化学反应速率加快,而后由于反应物的浓度减小,体系的温度变化不明显,从而化学反应速率逐渐减小,所以该反应的正反应为放热反应,故C错误;
D. 由图d可知,曲线a较曲线b达到平衡的时间短,反应速率较快,最终的平衡状态是相同的,当m+n=p时,曲线a相对曲线b可能为加压或加入催化剂,故D错误;
答案选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】观察图中 A、B、C 三个装置,回答下列问题:
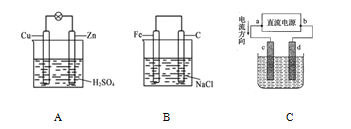
(1)把一块纯净的锌片插入装有稀硫酸的烧杯中,可观察到锌片上有气泡,再平行插入一铜片,可观察到铜片上_________(填“有”或“没有”)气泡产生。用导线把锌片和碳棒连接起来组成一个原电池(图A),正极的反应式为_______。
(2) 如果烧杯中最初装入的是 500 mL 2 mol·L-1 硫酸溶液,构成铜锌原电池,当收集到 11.2 L(标准状况下)H2 时,溶液体积变化忽略不计,则烧杯内溶液中硫酸的物质的量的浓度为_______mol/L。
(3) 如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(图 B),放置数天后,铁片生锈。负极反应式为_______。
(4) 图 C 是电解 CuCl2 溶液的装置,其中 c、d 为石墨电极。
①正极为_______(填“a”或“b”)。
②阳极电极反应式为_______,检验该阳极产物的方法是将_______试纸靠近电极。
③电解一段时间后发现阴极增重 6.4 g,若该电解反应所需的电子全部由氢氧燃料电池提供,则至少需要消耗_______L 氢气(标准状况下)才能满足需要。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.用分液漏斗可以分离乙酸乙酯和饱和碳酸钠溶液
B.用溴水除去甲烷中的乙烯气体
C.碳酸钠是焙制糕点所用的发酵粉主要成分之一
D.蒸馏是分离液态混合物一种常用方法,广泛应用于石油工业
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验及其分析叙述正确的是( )
A.向2.0mL浓度均为0.lmolL-l的KC1、KI混合溶液中滴加1~2滴0.0lmol/LAgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入适量的H2O2,铜粉仍不溶解
C.向AlC13溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀不消失
D.将CO2通入Ba(NO3)2溶液中至饱和,无沉淀产生;再通入SO2,也无沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】倒置的坩埚盖子上放入硫粉,在硫粉中央放一小块钠,按图示搭建装置,用胶头滴管向金属钠滴加一滴水,立即倒扣上大烧杯,发现坩埚盖子内火星四溅,烧杯内出现大量白烟,下列说法错误的是( )
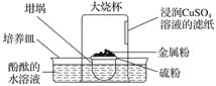
A.水是钠与硫反应的催化剂B.酚酞的水溶液变红色
C.钠与硫的反应是放热反应D.滤纸逐渐变黑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是人体重要的能源物质,请根据它们的性质回答以下问题:
(1)油脂在酸性和碱性条件下水解的共同产物是____________(写名称)。
(2)蛋白质的水解产物具有的官能团是____________和____________(写结构简式)。
(3)葡萄糖是一种重要的单糖,其分子结构中除含有五个羟基外还含有的官能团是____________(写结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
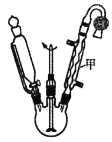
【题目】乙酰乙酸乙酯在医药上常用于合成维生素B。某化学小组在实验室中用如图装置制备乙酰乙酸乙酯。
已知:ⅰ.2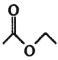
![]()
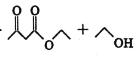
ⅱ.有关物质的性质:
沸点/℃ | 水中溶解性 | |
乙酸乙酯 | 77.2 | 难溶 |
乙酰乙酸乙酯 | 181 | 微溶 |
乙酸 | 118 | 易溶 |
实验步骤:
①向三颈烧瓶中加入9.2g无水乙酸乙酯,迅速加入0.1g切细的金属钠。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。
②向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
③水层用5mL无水乙酸乙酯萃取,分液。
④将①②所得有机层合并,洗涤、干燥、蒸馏得到乙酰乙酸乙酯粗产品。
⑤粗产品纯化得到乙酰乙酸乙酯4.2g。
回答下列问题:
(1)仪器甲的名称是__,水从__(填“上”或“下”)口进入。
(2)步骤②中加入饱和食盐水的作用是__。
(3)步骤④中洗涤时用饱和NaHCO3溶液,目的是__。
(4)步骤⑤中粗产品纯化的操作名称是__。
(5)本实验的产率为__%(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)________I1(Cu)(填“大于”或“小于”)。原因是______________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂__。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________,C原子的杂化形式为______。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为________。六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,Zn的密度为________g·cm-3(列出计算式)。
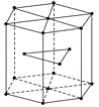
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com