
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 25℃、101kPa下Na2O(s)+O2(g)═2Na2O2(s)△H=-142kJ/mol | |
| D. | 25℃、101kPa下Na2O2(s)+2Na(g)═2Na2O(s)△H=-317kJ/mol |
分析 A.①和②产物的阴阳离子个数比均为1:2;
B.①和②生成等物质的量的产物,由Na元素的化合价判断转移电子;
C.根据盖斯定律②×2-①×2可得2Na2O(s)+O2(g)═2Na2O2(s);
D.由盖斯定律可知,①×2-②可得Na2O2(s)+2 Na(s)═2Na2O(s).
解答 解:A.①和②产物中阳离子均为钠离子,阴离子分别为氧离子,过氧根离子,则阴阳离子个数比均为1:2,故A错误;
B.①和②生成等物质的量的产物,由Na元素的化合价变化可知转移电子数相同,故B错误;
C.根据盖斯定律②×2-①×2可得:2Na2O(s)+O2(g)═2Na2O2(s)△H=(-511kJ/mol)×2-(-414kJ/mol)×2=-284kJ/mol,故C错误;
D.由盖斯定律可知①×2-②可得:Na2O2(s)+2 Na(s)═2Na2O(s),则△H=(-414kJ/mol)×2-(-511kJ/mol)=-317kJ/mol,故D正确;
故选D.
点评 本题考查反应热与焓变的应用,题目难度中等,涉及盖斯定律的应用、氧化还原反应的计算、物质的量的计算等知识,明确盖斯定律的内容为解答关键,试题培养了学生的分析能力及化学计算能力.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:选择题

| A. | 生成1 molHF气体放出的热量为270 KJ | |
| B. | H2(g)+F2(g)→2HF(l)+270 KJ | |
| C. | 反应物的总能量大于生成物的总能量 | |
| D. | 该反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 1 | 1 | 3 |
| 混合物的体积/g | 3.76 | 4.70 | 8.46 |
| 硫酸浓液的体积/mL | 50.00 | 50.00 | 50.00 |
| 生成一氧化碳的物质的量/mol | 0.03 | 0,0375 | 0.03 |
| A. | 样品中碳酸钾和碳酸氢钾的物成的量之比为1:2 | |
| B. | 样品中碳酸钾和碳酸氢钾的物质的量之比为2:3 | |
| C. | 所用硫酸的物质的量浓度为l.5mol•L-1 | |
| D. | 所用嫌酸的物质的量浓度为0.75mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 温度相同、体积相同的O2和O3 | B. | 质量相等、密度不等的C2H6和NO | ||
| C. | 质量相等、密度不等的CO和N2 | D. | 体积相等、密度相等的CO2和N2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

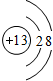 ,MgO的电子式
,MgO的电子式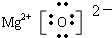 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 金刚烷的分子式是C10H16 | |
| B. | X的一种同分异构体是芳香族化合物 | |
| C. | 上述反应都属于取代反应 | |
| D. | 金刚烷胺的一溴代物有四种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
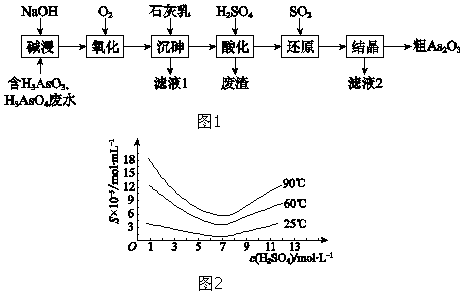
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com