
【题目】氧化还原反应在生产、生活中具有广泛的用途.下列事例不属于氧化还原反应的是( )
A.金属冶炼
B.燃放鞭炮
C.食物腐败
D.煅烧石灰石
科目:高中化学 来源: 题型:
【题目】实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)煤化工通常通过研究不同温度下的平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:
CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
①若在500℃时进行反应,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为 。
②800℃时,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L, c(H2)=0.05mol/L ,则反应开始时,H2的消耗速率比生成速率 (填“大”、“小”或“不能确定”)。
(2)2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示:又已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99 kJ·mol-1,请回答问题:
2SO3(g)反应过程中的能量变化如图所示:又已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99 kJ·mol-1,请回答问题:
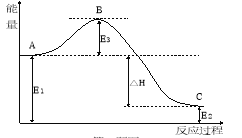
该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”或“降低” )△H (填“变大”、“变小”或“不变”);
(3)已知某反应的平衡常数表达式为:![]() ,它所对应反应的化学方程式为
,它所对应反应的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在10 mL浓度均为0.1 mol/LNaOH和NH3·H2O混合溶液中滴加0.1 mol/L盐酸,下列有关溶液中粒子浓度关系正确的是( )
A.未加盐酸时:c(OH-)>c(Na+)=c(NH3·H2O)
B.加入盐酸至溶液pH=7时:c(Cl-)=c(Na+)
C.加入10 mL盐酸时:c(NH![]() )+c(H+)=c(OH-)
)+c(H+)=c(OH-)
D.加入20 mL盐酸时:c(Cl-)=c(NH![]() )+c(Na+)
)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生课外活动小组利用右图所示装置分别做如下实验:

(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是_________溶液;加热时溶液由红色逐渐变浅的原因是:________________________________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________________溶液;加热时溶液由无色变为红色的原因是: ______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有______和______。
(2)锌与盐酸反应速率可以通过观察_________进行判断,也可通过实验测定。通过实验测定锌与盐酸反应速率,除测量反应时间外,还需要测量的物理量是_______或 _____。
(3)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
时间/min | 1 | 2 | 3 | 4 | 5 |
体积/mL | 50 | 120 | 232 | 290 | 310 |
①哪一时间段反应速率最大_______(填“0~1 min”或“1~2 min”或“2~3 min”或“3~4 min”或“4~5min”)。
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为____________。
③试分析1~3min时间段里,反应速率变大的主要原因_________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOC1)的沸点为-5.5℃,具有刺鼻恶臭味,在潮湿空气中易水解,溶于浓硫酸,是而机合成中的重要试剂。某同学用下图装置,由NO与干燥纯净的Cl2反应制备NOCl。

己知:①Cl2沸点为-34.6℃,NO2Cl沸点为-15℃
②2NO+Cl2= 2NOC1![]() 2NO2 + Cl2=2NO2C1
2NO2 + Cl2=2NO2C1
回答下列问题:
(1)铜与稀硝酸反应的化学方程式为_______________;装置A中设计了可上下移动的铜丝,其优点是_____________________。
(2)上图中实验装置的连接顺序为:a→__________________。
(3)实验时,先制取氯气使充满除A、B、C外的整套装置,目的是______________;
装置中充满氯气后,下—步是制取NO,具体操作是_______________;
E中冰盐水的温度可低至-22℃,其作用是_______________。
(4)该同学的实验设计可能的不足之处是__________________(答出一条即可)。
(5)若无C装置,则不利于NOCl的制备,主要原因是_________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 需要加热才能发生的反应一定是吸热反应
B. 由C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol,可知金刚石比石墨稳定
C. 自发反应的熵一定增大,非自发反应的熵一定减小
D. 等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )

A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com