
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4  2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol 电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol 电子时铁电极的质量减少11.2 g。请回答下列问题。

(1)A是铅蓄电池的 极,铅蓄电池正极反应式为 ,放电过程中电解液的密度 (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是 ,该电极的电极产物共 g。
(3)Cu电极的电极反应式是 ,CuSO4溶液的浓度 (填“减小”、“增大”或“不变”)。
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示 。

a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
(1)负 PbO2+4H++SO42-+2e-=PbSO4+2H2O 减小
(2)2H++2e-=H2↑ 0.4
(3)Cu-2e-=Cu2+ 不变 (4)b
【解析】根据在电解过程中铁电极质量的减少可判断A是电源的负极,B是电源的正极,电解时Ag极作阴极,电极反应式为2H++2e-=H2↑,Fe作阳极,电极反应式为Fe-2e-=Fe2+,左侧U形管中总反应式为Fe+2H+=Fe2++H2↑。右侧U形管相当于电镀装置,Zn电极作阴极,电极反应式为Cu2++2e-=Cu,铜电极作阳极,电极反应式为Cu-2e-=Cu2+,电镀过程中CuSO4溶液的浓度保持不变,根据上述分析可得答案。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源:2014年化学高考题型专练八 化学反应速率和化学平衡分析与判断练习卷(解析版) 题型:选择题
一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g)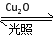 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
时间/min | 20 | 40 | 60 | 80 |
n(O2)/mol | 0.001 0 | 0.001 6 | 0.002 0 | 0.002 0 |
下列说法不正确的是 ( )。
A.前20 min内的平均反应速率v(H2O)=5.0×10-5 mol·L-1·min-1
B.达到平衡时,至少需要从外界吸收能量0.968 kJ
C.增大c(H2O),可以提高水的分解率
D.催化效果与Cu2O颗粒的大小有关
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练一 化学与科学技术社会环境的关系练习卷(解析版) 题型:选择题
下列因果关系不正确的是( )。
选项原因结果
A植树造林温室效应
BSO2和NO2气体大量排放酸雨
C汽车尾气的排放光化学烟雾
D含氮、磷等生活废水的大量排放赤潮
查看答案和解析>>
科目:高中化学 来源:2014年化学高考课时演练 7-3化学平衡常数化学反应进行方向练习卷(解析版) 题型:填空题
甲醇可通过将煤气化过程中生成的CO和H2在一定条件下,发生如下反应制得:CO(g)+2H2(g) CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)= ,CO的转化率为 。
(2)该反应的平衡常数表达式为 ,温度升高,平衡常数 (填“增大”、“减小”或“不变”)。
(3)若在一体积可变的密闭容器中充入1 mol CO、2 mol H2和1 mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则加入各物质后该反应向 (填“正”、“逆”)反应方向移动,理由是 。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考课时演练 7-3化学平衡常数化学反应进行方向练习卷(解析版) 题型:选择题
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示得出的判断结论正确的是( )
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示得出的判断结论正确的是( )

A.反应速率a>b>c
B.达到平衡时A2的转化率大小为:b>a>c
C.若T2>T1,则正反应是吸热反应
D.达到平衡时,AB3的物质的量大小为:c>b>a
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练9-2电解池金属电化学腐蚀与防护练习卷(解析版) 题型:选择题
如图中,两电极上发生的电极反应如下:

a极:Cu2+ + 2e-=Cu;
b极:Fe-2e-=Fe2+,则以下说法中不正确的是( )
A.该装置一定是原电池
B.a极上一定发生还原反应
C.a、b可以是同种电极材料
D.该过程中能量的转换可以是电能转化为化学能
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练9-2电解池金属电化学腐蚀与防护练习卷(解析版) 题型:选择题
下列有关金属保护方法的说法中正确的是( )
A.我们使用的快餐杯表面有一层搪瓷,搪瓷层破损后仍能起到防止铁生锈的作用
B.白铁(镀锌铁)镀层破损后,铁皮的腐蚀速率很慢
C.轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阴极的阳极保护法
D.钢铁制造的暖气管道外常涂有一层沥青,这是钢铁的电化学保护法
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 9-1原电池 化学电源练习卷(解析版) 题型:选择题
一种新型环保电池是采用低毒的铝合金(丢弃的易拉罐),家庭常用的漂白水,食盐,氢氧化钠(化学药品店常见试剂)等原料制作的。电池的总反应方程式为2Al+3ClO-+2OH-=3Cl-+2AlO2-+H2O。下列说法不正确的是( )
A.该电池的优点是电极材料和电解质用完后可以更换
B.该电池发生氧化反应的是金属铝
C.电极的正极反应式为3ClO-+3H2O+6e-=3Cl-+6OH-
D.当有0.1 mol Al完全溶解时,流经电解液的电子个数为1.806×1023
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-2水的电离和溶液的酸碱性练习卷(解析版) 题型:选择题
①pH=2的CH3COOH溶液;
②pH=2的盐酸;
③pH=12的氨水;
④pH=12的NaOH溶液。
相同条件下,有关上述溶液的比较中,正确的是( )
A.水电离的c(H+):①=②=③=④
B.将②、③溶液混合后,pH=7,消耗溶液的体积:②<③
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向溶液中加入100 mL水后,溶液的pH:③>④>①>②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com