
| A.HCl、HBr、HI稳定性依次减弱 |
| B.Na、Mg、Al的原子半径依次增大 |
| C.NaOH、KOH、CsOH碱性依次增强 |
| D.Li、Na、K、Rb、Cs单质的失电子能力逐渐增强 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题

| ⅠA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | ||||||
| 2 | | | | ① | ② | | ③ | | ||||||
| 3 | | ④ | ⑤ | | | ⑥ | ⑦ | ⑧ | ||||||
| 4 | ⑨ | | | | | | ⑩ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
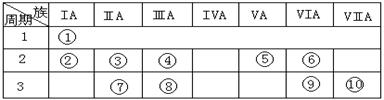
| A.同温同压下,元素⑩的气态氢化物溶解度大于元素⑨的气态氢化物 |
| B.元素的最高价氧化物对应的水化物的酸性⑩强于⑨ |
| C.元素⑨和⑩的单质与铁反应分别得到低价、高价铁的化合物 |
| D.元素⑩的电负性大于元素⑨ |
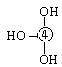 则可判断该酸为 酸(填强或弱)
则可判断该酸为 酸(填强或弱) Cl Cl Cl
Cl Cl Cl查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| W | 周期表中原子半径最小的元素 |
| U | 地壳中含量最多的金属元素 |
| R | 单质为空气的主要成分 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素的价电子数和所在族的族序数相等 |
| B.钠、钾、铷的第一电离能逐渐减小 |
| C.CsCl晶体中每个Cs+周围紧邻的Cl-和每个Cl-周围紧邻的Cs+个数相同 |
| D.〔Co(NH3)6〕3+中配体为NH3,中心离子为Co3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
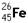 原子,有关
原子,有关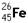 的说法正确的是( )
的说法正确的是( )| A.它是一种新元素 | B.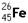 与 与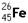 互为同素异形体 互为同素异形体 |
| C.它是一种新原子 | D.这种铁原子的中子数是26 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.制备催化剂的元素 | B.耐高温的合金元素 |
| C.制备农药的元素 | D.用于半导体材料的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com