
| m |
| M |
| m |
| M |
| m |
| M |
| m |
| M |
| 8g |
| 16g/mol |
| 88g |
| 44g/mol |
| mg |
| 48g/mol |
| m |
| 48 |
| m |
| 48 |
| 22.4m |
| 48 |
| m |
| 48 |
| 22.4m |
| 48 |
| mg |
| 32g/mol |
| mg |
| 64g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
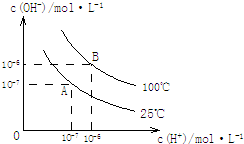 在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的PH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.01×1023 个 |
| B、0.5mol |
| C、1.505×1024 个 |
| D、1.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/物质的量 | n(X)/mol | n(Y)/mol | n(Z)/mol |
| 起始 | 1.600 | 3.200 | 0.000 |
| 第2min | a | 2.700 | 0.400 |
| 第4min | 0.600 | 1.950 | 1.000 |
| 第6min | 0.600 | 1.950 | 1.000 |
| A、若升高反应体系的温度,平衡时体系中X%将减小 |
| B、若增大反应体系的压强,平衡时体系中Z%将增大 |
| C、表中的a=1.200,当反应达平衡时,X的转化率为16.90% |
| D、不论该反应是否在催化剂存在的条件下进行,平衡时体系中Y%保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com