
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O,工艺流程如下(部分操作和条件略):

(1)滤渣a可用于制造
(2)请将MnO4-氧化Fe2+的离子方程式补充完整:
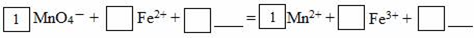
若反应中转移了2mol电子,则消耗氧化剂的物质的量为 mol。
(3)已知生成氢氧化物沉淀的pH如下:
|
|
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀时 |
3.4 |
6.3 |
1.5 |
|
完全沉淀时 |
4.7 |
8.3 |
2.8 |
调节溶液pH约为3的目的是: 。
(4)取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体,说明滤渣C的主要成分是 。请写出加入MnSO4时所发生反应的离子方程式: 。
(5)A12(SO4)3·18H2O溶于水溶液呈酸性的原因: 。(用离子方程式表示)
(1)光导纤维 (1分)
(2)5、8 H+、5、4 H2O (2分);0.4mol(各2分)
(3)使溶液中的Fe3+完全沉淀(2分)
(4)MnO2(1分) 2 MnO4- +3Mn2+ +2H2O=5MnO2+4 H+(2分)
(5)Al3++3H2O Al(OH)3+3 H+(2分)
Al(OH)3+3 H+(2分)
【解析】
试题分析:(1)二氧化硅不与酸反应,所以滤渣a中有二氧化硅,二氧化硅可以做光导纤维;
(2)锰元素作为氧化剂由+7价被还原为+2价,亚铁离子作为还原剂由+2价被氧化为+3价;
(3)三价铁离子在PH接近3时会完全沉淀;
(4)双氧水在二氧化锰做催化剂的条件下放出氧气;
(5)铝离子水解所以呈酸性。
考点:氧化还原反应。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2013-2014学年广东省高三上学期期中考试理综化学试卷(解析版) 题型:填空题
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
H2SO4溶解A12O3的离子方程式是
将KMnO4 氧化Fe2+的离子方程式补充完整:
 MnO4-+□Fe2++□
=
MnO4-+□Fe2++□
= Mn2++□Fe3+
+□
Mn2++□Fe3+
+□
上式中氧化剂是 ,氧化产物是 。
(3)已知:生成氢氧化物沉淀的pH
|
|
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀时 |
3.4 |
6.3 |
1.5 |
|
完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的: 。
己知:一定条件下,MnO4 - 可与Mn2+反应生成MnO2。
① 向 Ⅲ 的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 。
② Ⅳ 中加入MnSO4的目的是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省成都市高三第一次诊断考试理综化学试卷(解析版) 题型:填空题
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解A12O3的离子方程式是
(2)KMnO4 - 氧化Fe2+的离子方程式补充完整:

(3)已知:生成氢氧化物沉淀的pH
|
|
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀时 |
3.4 |
6.3 |
1.5 |
|
完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的: 。
(4)己知:一定条件下,MnO4 - 可与Mn2+反应生成MnO2。
① 向 Ⅲ 的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 。
② Ⅳ 中加入MnSO4的目的是 。
查看答案和解析>>
科目:高中化学 来源:2014届福建省四地六校高三上学期第二次月考化学试卷(解析版) 题型:填空题
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O,工艺流程如下(部分操作和条件略):

(1)滤渣a可用于制造 。
(2)请将MnO4-氧化Fe2+的离子方程式补充完整:
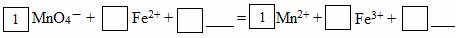
若反应中转移了2mol电子,则消耗氧化剂的物质的量为 mol。
(3)已知生成氢氧化物沉淀的pH如下:
|
|
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀时 |
3.4 |
6.3 |
1.5 |
|
完全沉淀时 |
4.7 |
8.3 |
2.8 |
调节溶液pH约为3的目的是: 。
(4)取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体,说明滤渣C的主要成分是 。请写出加入MnSO4时所发生反应的离子方程式: 。
(5)A12(SO4)3·18H2O溶于水溶液呈酸性的原因: 。(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省江门市高考模拟考试理综化学试卷(解析版) 题型:填空题
化工原料红矾钠(重铬酸钠:Na2Cr2O7•2H2O)主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有A12O3、 SiO2等杂质)为主要原料生产,其主要工艺流程如下:
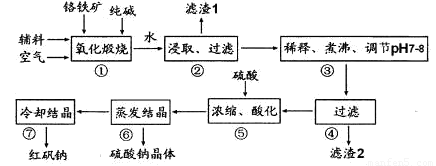
步骤①中主要反应的化学方程式为:4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是 。
(2)杂质A12O3、SiO2在①中转化的化学反应方程式为 。
(3)用化学平衡移动原理说明③中煮沸的作用是 (用离子方程式结合文字说明),若调节pH过低产生的影响是 。
(4)⑤中酸化是使CrO42一转化为Cr2O72一,写出该反应的离子方程式: 。
(5)工业上还可用电解法制备重铬酸钠,其装置示意图如下:

阴极发生的电极反应式为: 。
阳极发生的电极反应式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com