
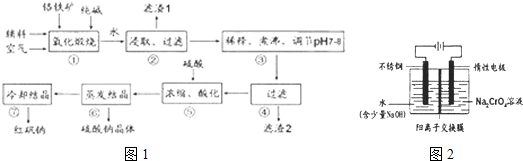
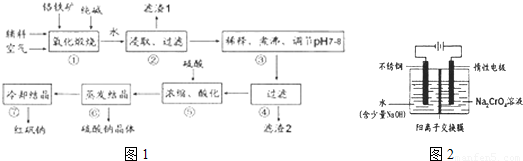
化工原料红矾钠(重铬酸钠:Na2Cr2O7•2H2O)主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有A12O3、 SiO2等杂质)为主要原料生产,其主要工艺流程如下:
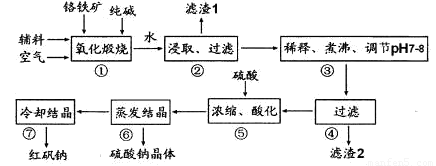
步骤①中主要反应的化学方程式为:4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是 。
(2)杂质A12O3、SiO2在①中转化的化学反应方程式为 。
(3)用化学平衡移动原理说明③中煮沸的作用是 (用离子方程式结合文字说明),若调节pH过低产生的影响是 。
(4)⑤中酸化是使CrO42一转化为Cr2O72一,写出该反应的离子方程式: 。
(5)工业上还可用电解法制备重铬酸钠,其装置示意图如下:

阴极发生的电极反应式为: 。
阳极发生的电极反应式为: 。
(17分)
(1)增大反应物的接触面积(1分),加快反应速率(1分)
(2)Al2O3+Na2CO3 2NaAlO2+CO2↑ (2分) SiO2+Na2CO3
2NaAlO2+CO2↑ (2分) SiO2+Na2CO3 Na2SiO3+CO2↑
(2分)
Na2SiO3+CO2↑
(2分)
(3)水解吸热,煮沸促进AlO2-+2H2O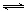 Al(OH)3+OH-(1分),SiO32-+H2O
Al(OH)3+OH-(1分),SiO32-+H2O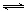 HSiO3-+OH-(1分)水解平衡向右移动,生成氢氧化铝、硅酸沉淀(1分)(合理即给分)
HSiO3-+OH-(1分)水解平衡向右移动,生成氢氧化铝、硅酸沉淀(1分)(合理即给分)
H+将水解生成的氢氧化铝沉淀溶解(1分),杂质Al3+难与Na2CrO4分离(1分)(合理即给分)
(4)2CrO42-+ 2H+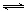 Cr2O72-+ H2O (2分,写=不扣分)
Cr2O72-+ H2O (2分,写=不扣分)
(5)阴极:4H2O+4e-=4OH-+2H2↑ 或 2H2O+2e-=2OH-+H2↑
或4 H++4e-=2H2↑ 或2 H++2e-=H2↑(2分)
阳极:2H2O-4e-= O2↑+4H+ 或 4OH-—4e-=O2↑+2H2O (2分)
【解析】
试题分析:(1)①中固体反应物与空气中的氧气发生反应时,不断搅拌能增大反应物的接触面积,加快反应速率;(2)氧化铝是两性氧化物,二氧化硅是酸性氧化物,都能与NaOH反应生成盐和水,则Al2O3+Na2CO3 2NaAlO2+CO2↑、SiO2+Na2CO3
2NaAlO2+CO2↑、SiO2+Na2CO3 Na2SiO3+CO2↑;(3)由于①中除杂试剂一定过量,则氧化煅烧、冷却、溶解后所得滤渣的主要成分是氧化铁等难溶物,滤液中主要成分是铬酸钠、偏铝酸钠、硅酸钠、碳酸钠,由于酸性:碳酸>硅酸>氢氧化铝,则水解程度:偏铝酸钠>硅酸钠>碳酸钠,因为它们的水解反应是吸热反应,则③中煮沸的作用是促进AlO2-+2H2O
Na2SiO3+CO2↑;(3)由于①中除杂试剂一定过量,则氧化煅烧、冷却、溶解后所得滤渣的主要成分是氧化铁等难溶物,滤液中主要成分是铬酸钠、偏铝酸钠、硅酸钠、碳酸钠,由于酸性:碳酸>硅酸>氢氧化铝,则水解程度:偏铝酸钠>硅酸钠>碳酸钠,因为它们的水解反应是吸热反应,则③中煮沸的作用是促进AlO2-+2H2O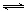 Al(OH)3+OH-、SiO32-+H2O
Al(OH)3+OH-、SiO32-+H2O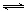 HSiO3-+OH-或SiO32-+2H2O
HSiO3-+OH-或SiO32-+2H2O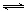 H2SiO3-+2OH-水解平衡向右移动,生成氢氧化铝、硅酸沉淀,即成为滤渣2的主要成分;若调节pH过低,酸性过强,由于氢氧化铝是两性氢氧化物,则H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+难与Na2CrO4分离;(4)④的滤液的主要成分是铬酸钠、碳酸钠,则⑤酸化的原理是铬酸钠、碳酸钠分别与硫酸反应,生成重铬酸钠、硫酸钠等,则2CrO42-+ 2H+
H2SiO3-+2OH-水解平衡向右移动,生成氢氧化铝、硅酸沉淀,即成为滤渣2的主要成分;若调节pH过低,酸性过强,由于氢氧化铝是两性氢氧化物,则H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+难与Na2CrO4分离;(4)④的滤液的主要成分是铬酸钠、碳酸钠,则⑤酸化的原理是铬酸钠、碳酸钠分别与硫酸反应,生成重铬酸钠、硫酸钠等,则2CrO42-+ 2H+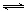 Cr2O72-+ H2O,加入硫酸能增大氢离子浓度,使该反应的平衡右移,将铬酸钠转化为重铬酸钠;(5)读图,与负极相连的不锈钢是阴极,阳离子移向阴极,氢离子比钠离子容易得到电子,则阴极反应式为2 H++2e-=H2↑或4 H++4e-=2H2↑或2H2O+2e-=2OH-+H2↑或4H2O+4e-=4OH-+2H2↑;与正极相连的惰性电极为阳极,阴离子移向阳极,氢氧根离子比铬酸根离子容易失去电子,则阳极反应式为4OH-—4e-=O2↑+2H2O或2H2O-4e-= O2↑+4H+,则阳极附近溶液的pH减小,使平2CrO42-+ 2H+
Cr2O72-+ H2O,加入硫酸能增大氢离子浓度,使该反应的平衡右移,将铬酸钠转化为重铬酸钠;(5)读图,与负极相连的不锈钢是阴极,阳离子移向阴极,氢离子比钠离子容易得到电子,则阴极反应式为2 H++2e-=H2↑或4 H++4e-=2H2↑或2H2O+2e-=2OH-+H2↑或4H2O+4e-=4OH-+2H2↑;与正极相连的惰性电极为阳极,阴离子移向阳极,氢氧根离子比铬酸根离子容易失去电子,则阳极反应式为4OH-—4e-=O2↑+2H2O或2H2O-4e-= O2↑+4H+,则阳极附近溶液的pH减小,使平2CrO42-+ 2H+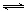 Cr2O72-+ H2O衡右移,将铬酸钠转化为重铬酸钠。
Cr2O72-+ H2O衡右移,将铬酸钠转化为重铬酸钠。
考点:考查有关物质制备的化学工艺流程,涉及解释搅拌的作用、化学方程式、解释原因、离子方程式、阴极反应式、阳极反应式等。


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
 Cr2O72-+H2O
Cr2O72-+H2O Cr2O72-+H2O
Cr2O72-+H2O查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2013年广东省江门市高考化学一模试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com