
 2NaAlO2+CO2↑,二氧化硅与硅酸钠反应生成硅酸钠和二氧化碳,反应的化学方程式为SiO2+Na2CO3
2NaAlO2+CO2↑,二氧化硅与硅酸钠反应生成硅酸钠和二氧化碳,反应的化学方程式为SiO2+Na2CO3 Na2SiO3+CO2↑,故答案为:Al2O3+Na2CO3
Na2SiO3+CO2↑,故答案为:Al2O3+Na2CO3 2NaAlO2+CO2↑;SiO2+Na2CO3
2NaAlO2+CO2↑;SiO2+Na2CO3 Na2SiO3+CO2↑;
Na2SiO3+CO2↑; Cr2O72-+H2O,故答案为:2CrO42-+2H+
Cr2O72-+H2O,故答案为:2CrO42-+2H+ Cr2O72-+H2O;
Cr2O72-+H2O; Cr2O72-+H2O;(5)从离子放电顺序的角度分析.
Cr2O72-+H2O;(5)从离子放电顺序的角度分析. 

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
 Cr2O72-+H2O
Cr2O72-+H2O Cr2O72-+H2O
Cr2O72-+H2O查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省江门市高考模拟考试理综化学试卷(解析版) 题型:填空题
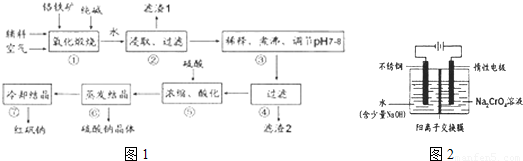
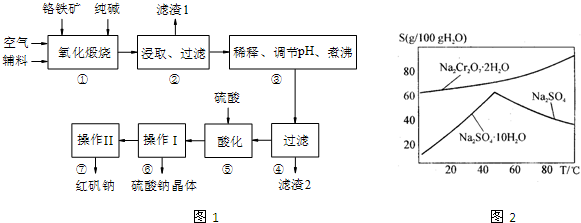
化工原料红矾钠(重铬酸钠:Na2Cr2O7•2H2O)主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有A12O3、 SiO2等杂质)为主要原料生产,其主要工艺流程如下:
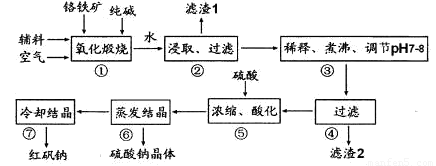
步骤①中主要反应的化学方程式为:4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是 。
(2)杂质A12O3、SiO2在①中转化的化学反应方程式为 。
(3)用化学平衡移动原理说明③中煮沸的作用是 (用离子方程式结合文字说明),若调节pH过低产生的影响是 。
(4)⑤中酸化是使CrO42一转化为Cr2O72一,写出该反应的离子方程式: 。
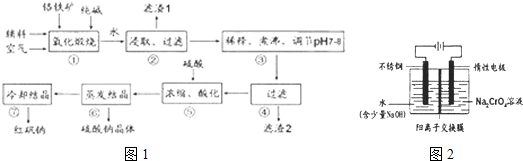
(5)工业上还可用电解法制备重铬酸钠,其装置示意图如下:

阴极发生的电极反应式为: 。
阳极发生的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com