
【题目】为了探索外界条件对反应X(g)+Y(?)![]() cZ(g)的影响,以X和Y物质的量之比为1:1开始反应,通过实验得到不同条件下平衡时Z的体积分数,实验结果如图所示。下列判断正确的是
cZ(g)的影响,以X和Y物质的量之比为1:1开始反应,通过实验得到不同条件下平衡时Z的体积分数,实验结果如图所示。下列判断正确的是
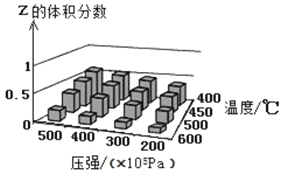
A. △H>0 c<2
B. 400℃、4×l07Pa下,该反应达平衡时X的体积分数是25%
C. Y可以是气体也可以是非气体
D. 反应物的转化率随压强增大而减小
【答案】B
【解析】由图像可见,在相同压强下,升高温度,Z的体积分数减小即平衡逆向移动,正反应为放热反应,ΔH![]() 0;在相同温度下,增大压强,Z的体积分数增大即平衡正向移动,正反应为气体分子数减小的反应,则Y一定是气体且c=1。A项,根据上述分析,ΔH
0;在相同温度下,增大压强,Z的体积分数增大即平衡正向移动,正反应为气体分子数减小的反应,则Y一定是气体且c=1。A项,根据上述分析,ΔH![]() 0,c=1
0,c=1![]() 2,错误;B项,由图读出400℃、4×l07Pa下达到平衡时Z的体积分数为0.5,X与Y的体积分数之和为0.5,X、Y开始物质的量之比为1:1,转化的X、Y的物质的量之比为1:1,平衡时X、Y物质的量之比也一定为1:1,则反应达平衡时X的体积分数为25%,正确;C项,Y一定是气体,错误;D项,增大压强平衡正向移动,反应物的转化率增大,错误;答案选B。
2,错误;B项,由图读出400℃、4×l07Pa下达到平衡时Z的体积分数为0.5,X与Y的体积分数之和为0.5,X、Y开始物质的量之比为1:1,转化的X、Y的物质的量之比为1:1,平衡时X、Y物质的量之比也一定为1:1,则反应达平衡时X的体积分数为25%,正确;C项,Y一定是气体,错误;D项,增大压强平衡正向移动,反应物的转化率增大,错误;答案选B。


科目:高中化学 来源: 题型:
【题目】(1)990C时,Kw=1.0×10-12mol2·L-2,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______________________.
②该温度下,将0.01 mol· L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH均为1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气______(填字母)
A.盐酸多 B.H2A多 C.一样多 D.无法确定
(2)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O![]() CH3CH2OH +CH3COOH实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
CH3CH2OH +CH3COOH实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。

①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入_______(填化学式),电极反应式为_______。
②在实际工艺处理中,阴极区乙醛的去除率可达80%。若在两极区分别注入1m3乙醛含量为3000mg·L-1的废水,可得到乙醇_____kg(计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯气的叙述中,正确的是( )
A.氯气以液态形式存在时可称为氯水或液氯
B.红热的铜丝在氯气中燃烧,冒蓝色烟
C.有氯气参加的化学反应必须在溶液中进行
D.钠在氯气中燃烧生成白色固体氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni2O3主要用作陶瓷、搪瓷和玻璃的着色剂,也可用于镍粉的制造。以镍粉废料为原料制备Ni2O3的工艺如下:

回答下列问题:
(1)Ni2O3中Ni的化合价为___________________________________。
(2)提高“酸浸”、“酸溶”速率时,温度不宜过高,其原因是_________________________。
(3)加入H2O2“氧化”的离子方程式为_________________________________________;滤渣A的主要成分是________________(填化学式)。
(4)工艺中分步加入Na2CO3的作用是________________________________;为提高原料的利用率,应控制加入NaClO与NaOH的物质的量之比为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 澄清石灰水可用来鉴别Na2CO3和NaHCO3溶液
B. 能使湿润的碘化钾淀粉试纸变蓝的物质不一定是氯气
C. 常温下浓硝酸和稀硝酸均可用铁质容器盛装
D. 浓硫酸有氧化性,稀硫酸没有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称为人体冷冻学之父的罗伯特·埃廷格在1962年写出《不朽的前景》一书。他在书中列举了大量事实,证明了冷冻复活的可能。比如,许多昆虫和低等生物冬天都冻僵起来,春天又自动复活。下列结论中与上述信息相关的是( )
A.化学反应前后质量守恒B.低温下分子无法运动
C.温度降低,化学反应停止D.温度越低,化学反应越慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二水氯化钡晶体(BaCl22H2O)在工业上主要用于制造各种钡盐、颜料和有机染料,某研究小组以重晶石(主要成分 BaSO4)制备BaCl22H2O 流程如下图。
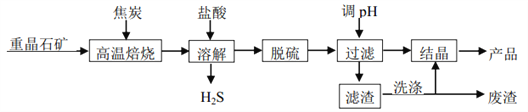
(1)已知:
① BaSO4(s)+ 4C(s)= 4CO(g) + BaS(s) △H1 = 571.2kJmol﹣1
② C(s)+ CO2(g)= 2CO(g) △H2 = 172.5 kJmol﹣1
反应 BaSO4(s)+ 2C(s)= 2CO2(g)+ BaS(s)的△H = _____ kJmol﹣1
(2)高温焙烧须加入过量的炭,同时还要通入空气,其目的是_____、_____。
(3)脱硫过程中分为两步, 第一步是物理脱硫, 第二步是化学脱硫。
① 物理脱硫是直接用蒸汽升温,并用空气“爆气法”除去的物质是_____。
② 下列物质不宜用作脱硫剂的是_____ (填字母)。
A. 高锰酸钾 B. 次氯酸钠 C. 双氧水 D.氯气
(4)上述流程中洗涤滤渣的主要目的是_____。
(5)溶解时产生的 H2S 可用 80~85 ℃时的石灰氮料浆(CaCN2的浆水混合物)吸收并制得更有价值的产品——硫脲[CS(NH2)2]和熟石灰。请写出制备硫脲的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O。下列说法正确的是()。

A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C. 反应一段时间后.向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280mL(标准伏况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com