
【题目】(1)990C时,Kw=1.0×10-12mol2·L-2,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______________________.
②该温度下,将0.01 mol· L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH均为1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气______(填字母)
A.盐酸多 B.H2A多 C.一样多 D.无法确定
(2)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O![]() CH3CH2OH +CH3COOH实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
CH3CH2OH +CH3COOH实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。

①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入_______(填化学式),电极反应式为_______。
②在实际工艺处理中,阴极区乙醛的去除率可达80%。若在两极区分别注入1m3乙醛含量为3000mg·L-1的废水,可得到乙醇_____kg(计算结果保留小数点后1位)
【答案】 H2A=2H+ + A2- 3 C CH4 CH4+10OH- - 8e- =CO32-+7H2O 2.5
【解析】试题分析:(1) ①990C时,Kw=1.0×10-12mol2·L-2,990C时PH=6的溶液呈中性;②该温度下,将0.01 mol· L-1 H2A溶液中氢离子浓度为0.02 mol· L-1,稀释到20倍后,氢离子浓度为0.001 mol· L-1;③盐酸与H2A都是强酸,体积相等、pH均为1的盐酸与H2A溶液氢离子的物质的量相同。(2)①根据装置图,Na+移向d电极,说明d是阴极,则b是负极;②电解池阴极发生还原反应,阴极的电极反应为![]() ,根据电极反应计算乙醇的产量。
,根据电极反应计算乙醇的产量。
解析:(1) ①990C时,Kw=1.0×10-12mol2·L-2,所以990C时PH=6的溶液呈中性,0.1 mol·L-1 Na2A溶液的pH=6,说明H2A是强酸, H2A在水溶液中的电离方程式为H2A=2H+ + A2-;②该温度下,将0.01 mol· L-1 H2A溶液中氢离子浓度为0.02 mol· L-1,稀释到20倍后,氢离子浓度为0.001 mol· L-1,PH=![]() =3;③盐酸与H2A都是强酸,体积相等、pH均为1的盐酸与H2A溶液氢离子的物质的量相同,与足量的Zn反应,产生的氢气一样多。
=3;③盐酸与H2A都是强酸,体积相等、pH均为1的盐酸与H2A溶液氢离子的物质的量相同,与足量的Zn反应,产生的氢气一样多。
(2)①根据装置图,Na+移向d电极,说明d是阴极,则b是负极,甲烷碱性燃料电池b极应通入的是CH4;b电极反应式为CH4+10OH- - 8e- =CO32-+7H2O;
②1m3乙醛含量为3000mg·L-1的废水含有乙醛的质量为3Kg,设生成乙醇的质量为xg
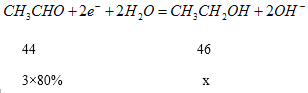
![]()
x=2.5Kg


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】250C时纯水的电离度为a1,pH=2的醋酸溶液中水的电离度为a2,pH=12的氢氧化钠溶液中水的电离度为a3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a4.下列关系式中正确的是( )
A. a2=a3<a4<a1 B. a3=a2<a1<a4 C. a2<a3<a1<a4 D. a1<a2<a3<a4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的化学式、名称、俗名不完全对应的是()
A. NaCl 氯化钠 食盐
B. CaO 氧化钙 熟石灰
C. H2O2 过氧化氢 双氧水
D. NaOH 氢氧化钠 烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钠滴定法测定高锰酸钾的质量分数的步骤如下。
Ⅰ.称取0.80g的高锰酸钾产品,配成50ml溶液。
Ⅱ.称取0.2014g Na2C2O4,置于锥形瓶中,加入蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ.将瓶中溶液加热至75—800C,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液8.48ml。
(1)步骤Ⅰ中用到的玻璃仪器有小烧杯、________、___________、_________。
(2)滴定时,高锰酸钾溶液置于__________滴定管中(填“酸式”或“碱式”)
(3)判断达到滴定终点的标志是____________________________。
(4)加热温度大于900C,部分草酸发生分解,会导致测得产品纯度____________(填“偏高”“偏低”或“无影响”)
(5)试写出反应的离子方程式__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿主要成分是FeS2 。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。(M(FeS2)=120g/mol)
已知:SO2 + Fe3+ + H2O ——SO42- +Fe2+ + H+
Cr2O7 2-+ 6 Fe2+ + 14 H+ ==== 2 Cr3+ + 6 Fe3+ + 7 H2O
(1)将此方程式配平:_______________________________________________________________H+
(2)样品中FeS2的质量分数是(假设杂质不参加反应)________________。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________L,制得98%的硫酸 质量为__________ t 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由 Al、CuO、Fe2O3 组成的混合物共 10.0g,放入 500mL 某浓度盐酸溶液中,混合物完全溶解,当再 加入 250mL 2.0mol/L 的 NaOH 溶液时,得到的沉淀最多。该盐酸的浓度为( )
A. 0.5 mol/L B. 3.0 mol/L C. 1.0 mol/L D. 2.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探索外界条件对反应X(g)+Y(?)![]() cZ(g)的影响,以X和Y物质的量之比为1:1开始反应,通过实验得到不同条件下平衡时Z的体积分数,实验结果如图所示。下列判断正确的是
cZ(g)的影响,以X和Y物质的量之比为1:1开始反应,通过实验得到不同条件下平衡时Z的体积分数,实验结果如图所示。下列判断正确的是
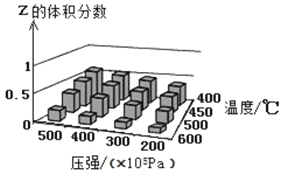
A. △H>0 c<2
B. 400℃、4×l07Pa下,该反应达平衡时X的体积分数是25%
C. Y可以是气体也可以是非气体
D. 反应物的转化率随压强增大而减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com