
| 6-2×2 |
| 2 |
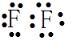 ,故答案为:
,故答案为: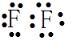 ;
;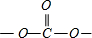 中,C原子呈2个C-O单键,属于σ键,1个C=O双键,双键按单键计算,故中心C原子的杂化轨道数为3,采取sp2杂化,为平面正三角形,键角为120°,故O-C-O的键角约为 120°,
中,C原子呈2个C-O单键,属于σ键,1个C=O双键,双键按单键计算,故中心C原子的杂化轨道数为3,采取sp2杂化,为平面正三角形,键角为120°,故O-C-O的键角约为 120°,

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
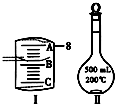 实验室要用Na2CO3?10H2O晶体配制500mL 0.1mol?L-1 Na2CO3溶液,回答下列问题:
实验室要用Na2CO3?10H2O晶体配制500mL 0.1mol?L-1 Na2CO3溶液,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、LiOH易溶于水 |
| B、电解前LiCl在加热时已发生水解 |
| C、无色气体为电解生成的H2 |
| D、Li和水反应要比Na和水剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+的物质的量 |
| B、醋酸的电离常数 |
| C、中和时所需NaOH的量 |
| D、溶液的导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
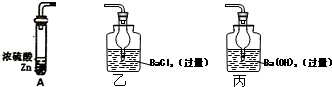
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16 g |
| B、32 g |
| C、64 g?mol-1 |
| D、32 g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进入煤矿井时,用火把照明 |
| B、在开阔广场燃放烟花爆竹 |
| C、用点燃的火柴检验液化气钢瓶是否漏气 |
| D、进入下水道时,应用蜡烛照明 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com