
科目:高中化学 来源: 题型:
氯化铁溶液与氢氧化铁胶体的共同点是 ( )
A.分散质颗粒直径都在l~100nm之间 B. 颜色都呈红褐色
C. 一束平行光照射溶液时,从侧面都可以看到一束光束 D.都是分散系
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子一定能在指定环境中大量共存的是 ( )
A.在c(H+)=10-10 mol/L的溶液中 Al3+ 、NH 、Cl- 、NO
、Cl- 、NO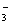
B.pH值为1的溶液 Fe2+、Na+ 、SO42-、NO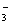
C.水电离出来的c(H+)=10-12mol/L的溶液 K+、HCO3-、Cl-、ClO-
D.pH值为13的溶液 K+、CO 、Na+、AlO2-
、Na+、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
按下图所示装置进行实验,并回答下列问题:
(1)判断装置的名称:A池为____,B池为____。
(2)锌极为____极,电极反应式为__ _;
铜极为_____极,电极反应式为__________ ;
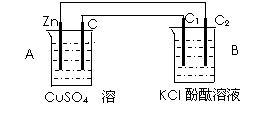
石墨棒C1为____极,电极反应式为____ ;
石墨棒C2附近发生的实验现象为________ 。
(3)当C2极析出224 mL气体(标准状况下),锌的质量变化为(增加或减少)__________g。
CuSO4溶液的质量变化为(增加或减少)__________g。
(4)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl--2e-=Cl2↑
d.1 mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验是研究化学的基础,下图中所示的实验方法、装置或操作均正确的是 ( )


A.除去混有的杂质气体 B.浓硫酸稀释

C.分离出AgNO3溶液中的AgCl D.称量30.46g的NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
用等体积的的 1 mol·L-1的BaCl2溶液,可使相同体积的Na2SO4 、Fe2(SO4)3 、KAl(SO4)2三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为 ( )
A.1︰3︰2 B.6︰2︰3 C.1︰1︰1 D.3︰1︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
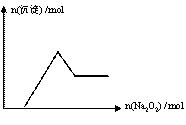
有一无色透明溶液,取出少量滴入BaCl2溶液,只有白色沉淀生成;另取一定体积的无色溶液加入过量Na2O2,有无色无味气体产生,同时有白色沉淀生成,其沉淀量与加入Na2O2的量的关系如下图所示,根据以上判断在 ①H+ ②NH4+ ③Al3+ ④Mg2+ ⑤Fe2+ ⑥NO3- ⑦SO42- ⑧CO32-中一定存在的离子是 ( )
A.③④⑧ B.③④⑦
C.①③④⑦ D.①③④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
温度压强一定,在催化剂铁触媒作用下,向一密闭容器充入N2、H2和NH3 。若起始时n(N2)=x mol、n(H2)=y mol、n(NH3)=z mol (x、y、z均不为0 ),平衡时n(N2)=0.1mol、n(H2)=0.3mol、n(NH3)=0.08mol。下列有关判断不合理的是:
A.N2、H2的转化率不相等
B.平衡时,H2与NH3的生成速率之比为3:2
C.x : y =1:3
D.x的取值范围为0<x<0.14
查看答案和解析>>
科目:高中化学 来源: 题型:
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列分析中正确的是
A.白色沉淀是CuI2,棕色溶液含有I2
B.滴加KI溶液时,转移1mole-时生成1mol白色沉淀
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com