
酸雨的形成主要是由于
A、森林遭到乱砍滥伐,破坏了生态环境 B、含硫化石燃料的大量燃烧
C、大气中二氧化碳的含量增大 D、汽车排放大量尾气
科目:高中化学 来源: 题型:
苹果酸的结构简式为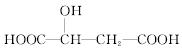 ,下列说法正确的是( )
,下列说法正确的是( )
A.苹果酸中能发生酯化反应的官能团有2种
B.1 mol苹果酸可与3 mol NaOH发生中和反应
C.1 mol苹果酸与足量金属Na反应生成1 mol H2
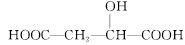 |
D. 与苹果酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于d轨道的说法错误的是
A.M层才开始出现d轨道 B.d轨道最早出现在第4周期元素
C.电子排布时,3d轨道能量高于4s轨道
D.d轨道有10种空间伸展方向
查看答案和解析>>
科目:高中化学 来源: 题型:
某金属(A)在TK以下晶体的基本结构单元如左下图所示,T K以上转变为右下图所示结构的基本结构单元,在两种晶体中最邻近的A原子间距离相同
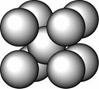

(1)在T K以下的纯A晶体中,与A原子等距离且最近的A原子数为______个;在T K以上的纯A晶体中,与A原子等距离且最近的A原子数为___________;
(2)纯A晶体在晶型转变前后,二者基本结构单元的边长之比为(TK以上与TK以下之比)___________。
(3)左上图的的堆积方式为 , TK以下经测定其结构和性质参数如下表所示
| 金属 | 相对原子质量 | 分区 | 原子半径/pm | 密度/g·㎝-3 | 原子化热/kJ·mol-1 |
| Na | 22.99 | s区 | 186 | 0.960 | 108.4 |
| A | 60.20 | d区 | r | 7.407 | 7735 |
则r= pm,试解释该晶体金属原子化热很高的原因
。
(已知 ,7.407≈
,7.407≈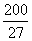 ,1pm=10
,1pm=10 m)
m)
查看答案和解析>>
科目:高中化学 来源: 题型:
工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2 + O2 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
A、使用催化剂是为了加快反应速率,提高生产效率
B、在上述条件下,SO2不可能100%地转化为SO3
C、为了提高SO2的转化率,应适当提高O2的浓度
D、达到平衡时,SO2的浓度与SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.【查阅资料】
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀盐酸。
Ⅱ.【制备产品】
实验装置如图所示(省略夹持装置):
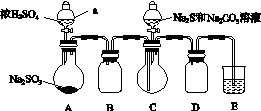
实验步骤:
(1)检查装置气密性,如图示加入试剂。
仪器a的名称是________;E中的试剂是________(选填下列字母编号)。
A.稀H2SO4
B.NaOH溶液
C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3的混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中的混合物,滤液经________(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.【探究与反思】
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____________________________________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是______________________________________________________________________________。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过________方法提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
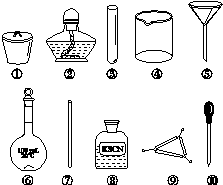
A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+,选用③、⑧和⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
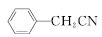 +H2O+H2SO4
+H2O+H2SO4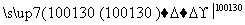
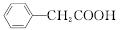 +NH4HSO4
+NH4HSO4
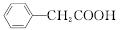 | |||
 | |||
+Cu(OH)2―→ +H2O
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
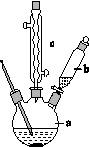
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL 70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是______________________________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是__________;仪器c的名称是__________,其作用是____________。
反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是____________。下列仪器中可用于分离苯乙酸粗品的是____________(填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是____________,最终得到44 g纯品,则苯乙酸的产率是____________。
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是__________________。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com