
将3.20 g Cu跟30.0 mL 10 mol·L-1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a mol H+,则此时溶液中含NO3-的物质的量为
A.(0.1+a)mol B.2a mol C.0.1a mol D.0.5a mol
科目:高中化学 来源:2014-2015甘肃省高二上学期期末化学试卷(解析版) 题型:选择题
下列比较正确的是:
A.电镀铜和电解精炼铜:两极质量变化相同均为△m(阴极)增=△m(阳极)减
B.电化学腐蚀和化学腐蚀:均发生了氧化还原反应且均伴随有电流产生
C.氯碱工业和工业冶炼钠:所用原料、反应条件均相同
D.牺牲阳极的阴极保护法和外加电流的阴极保护法:均有电子流向被保护设备并在其上发生还原反应
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(文)试卷(解析版) 题型:选择题
下列说法中正确的是
A.纯净水就是纯的水
B.与普通可饮用水相比,纯净水作为饮用水一定对人体更有利
C.与纯净水相比,蒸馏水作为饮用水对人体更有利
D.瓶装纯净水可开瓶直接饮用
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷(解析版) 题型:选择题
在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度为
A. B.
B. C.
C.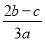 D.
D.
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷(解析版) 题型:选择题
下列实验操作完全正确的是
编号 | 实验 | 操作 |
A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
B | 实验室制备氢氧化铝 | 向盛有硫酸铝溶液的试管中逐滴滴加氢氧化钠至过量 |
C | 检验溶液中的Fe3+ | 向溶液中滴加几滴硫氰化钾溶液 |
D | 实验室制备氢氧化亚铁沉淀 | 向盛有硫酸亚铁溶液的试管中逐滴加入氢氧化钠溶液,并边滴加边振荡 |
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷(解析版) 题型:选择题
下列实验基本操作(或实验注意事项)中,主要是处于实验安全考虑的是
A.实验剩余的药品不能放回原试剂瓶 B.可燃性气体的验纯
C.气体实验装置在实验前进行气密性检查 D.滴管不能交叉使用
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三1月份阶段测试化学试卷(解析版) 题型:选择题
如图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断

A.正反应是吸热反应
B.若A、B是气体,则D是液体或固体
C.逆反应是放热反应
D.A、B、C、D均为气体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市普高高三上学期第一次诊断理综化学试卷(解析版) 题型:实验题
(14分)某同学在学习“硫酸及其盐的某些性质与用途”中,进行如下实验探究。
Ⅰ、探究硫酸的性质
(1)某同学设计下图装置(夹持和加热装置略)拟完成有关实验。但该装置在设计上存在明显的安全隐患是

(2)将上述装置改进确认不存在安全隐患并检验气密性后,将铜片放入圆底烧瓶中,通过分液漏斗向圆底烧瓶中滴加足量的浓硫酸,加热圆底烧瓶,充分反应后,观察到圆底烧瓶铜片不断溶解,但有铜片剩余,圆底烧瓶溶液呈蓝色,盛品红溶液的试剂瓶中溶液颜色褪去。回答下列问题:
①圆底烧瓶中发生反应的化学方程式为 。
②装置乙中的试剂是 。
(3)从装置中取下圆底烧瓶,向圆底烧瓶的溶液中持续鼓入空气并加热圆底烧瓶。观察到圆底烧瓶中的红色固体逐渐溶解并完全消失。此时发生反应的离子方程式为
(4)若要用(3)问所得溶液来制备硫酸四氨合铜晶体,其操作是 。
Ⅱ、用KHSO4制取H2O2并测其物质的量浓度。
(1)工业上电解KHSO4饱和溶液制取H2O2的示意图如下(已知:KHSO4=K++H++SO42-):

电解饱和KHSO4溶液时反应的离子方程式 。
(2)测定H2O2的物质的量浓度:
取20.00mL上述已制得的H2O2溶液置于锥形瓶中,加稀硫酸酸化 ②用0.1000mol/LKMnO4溶液滴定 ③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL,原H2O2溶液中H2O2的物质的量浓度为 。
(已知:滴定时该反应的还原产物是Mn2+,氧化产物是O2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com