
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
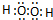 ,该元素另一种氢化物是水,K和水反应生成KOH和氢气,离子方程式为2K+2H2O═2K++2OH-+H2↑,故答案为:
,该元素另一种氢化物是水,K和水反应生成KOH和氢气,离子方程式为2K+2H2O═2K++2OH-+H2↑,故答案为: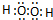 ;2K+2H2O═2K++2OH-+H2↑.
;2K+2H2O═2K++2OH-+H2↑.


科目:高中化学 来源: 题型:
| A、向NaHS溶液中通入Cl2:S2-+Cl2=S↓+2Cl- |
| B、向NaNO2溶液中滴加酸性KMnO4溶液:5NO2-+2MnO4-+3H2O=5NO3-+2Mn2++6OH- |
| C、向NH4HSO4溶液中滴加少量的Ba(OH)2溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3?H2O+H2O |
| D、向偏铝酸钠溶液中通入过量的CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲与金属反应时得电子的数目比乙多 |
| B、甲单质的熔沸点比乙的低 |
| C、甲的氧化物对应的水化物酸性比乙强 |
| D、甲能将乙的简单离子从其盐溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(K) CO2转化率% n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
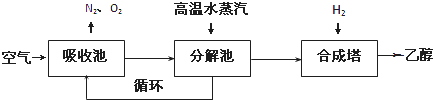
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |

| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 |
| B、用激光笔照射稀豆浆,有丁达尔效应,稀豆浆属于胶体 |
| C、向某溶液中加入NaOH溶液并加热,用湿润的红色石蕊试纸放在管口,若试纸变蓝说明原溶液中含NH4+ |
| D、向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com