
| A、3.01×1023 |
| B、6.02×1023 |
| C、0.5 |
| D、0.25 |
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
 研究确定六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途.下列推测正确的是( )
研究确定六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途.下列推测正确的是( )| A、SF6中各原子均达到8电子稳定结构 |
| B、SF6分子中既含有非极性共价键键又含有极性共价键 |
| C、SF6分子是含有极性键的非极性分子 |
| D、SF6可能是原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 945 |
| 5 |
| 4 |
| 1 |
| 4 |
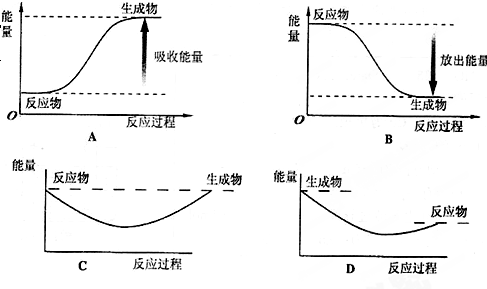
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体积比为8:11 |
| B、分子个数之比为11:12 |
| C、物质的量之比为8:11 |
| D、原子个数之比为11:12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1L 3.0mol/L的NH4NO3溶液中含有的NH4+的数目为0.3NA |
| B、等体积、等物质的量浓度的NaCl和KCl溶液中,阴、阳离子数目之和均为2NA |
| C、0.1mol/L的NaHSO4溶液中,阳离子的数目之和为0.2NA |
| D、25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸跟铁反应:Fe+6H+=2Fe3++3H2↑ |
| B、稀硫酸与氢氧化钡溶液反应:H++OH-=H2O |
| C、碳酸钙放入稀盐酸中:CO32+2H+=CO2↑+H2O |
| D、稀盐酸放入碳酸钠中:CO32+2H+=CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com