
����Ŀ���絼���Ǻ����������Һ����������С��������������Һ�絼�ʱ仯����ȷ���ζ���Ӧ���յ㡣��ͼ��ijͬѧ��0.1molL-1KOH��Һ�ֱ�ζ������Ϊ20mL��Ũ�Ⱦ�Ϊ0.1molL-1��HCl��CH3COOH��Һ�ζ�����ʾ��ͼ(�����Һ����仯���Բ���)�������й��жϲ���ȷ����

A������������0.1 molL-1 KOH��Һ�ζ�CH3COOH��Һ�ĵζ�����
B����A�����Һ���У�c(CH3COO-)+c(OH-)-c(H+)�T0.05 molL-1
C����B�����Һ���У�c(K+)��c(OH-)��c(CH3COO-)��c(H+)
D������ͬ�¶��£�C��ˮ�����c(H+)����A��ˮ�����c(H+)
���𰸡�D
��������
���������A����Һ��������������Ũ�ȳ����ȣ�CH3COOH��������ʣ���Һ������Ũ�Ƚ�С������KOH����Һ������Ũ��������Һ��������ǿ��HCl��ǿ����ʣ�����KOH��Һ���룬��Һ�����������Һ������Ũ�ȼ�С����Һ������������������ȫ��Ӧʽ����Ũ����С����������KOH��Һ������Ũ��������Һ����������ǿ������ͼ֪������������0.1 mol/L KOH��Һ�ζ�HC1��Һ�ĵζ����ߣ�����������0.1 mol/LKOH��Һ�ζ�CH3COOH��Һ�ĵζ����ߣ���A��ȷ��B���κε������Һ�ж����ڵ���غ㣬���ݵ���غ��c(CH3COO-)+c(OH-)-c(H+)=c(Na+)=0.05mol/L����B��ȷ��C��B��ʱ�������Һ��Ϊ�����ʵ���Ũ�ȵ�KOH��CH3COOK����Һ�ʼ��ԣ�CH3COO-ˮ��̶Ƚ�С����������غ������Ũ�ȴ�С˳����c(K+)��c(OH-)��c(CH3COO-)��c(H+)����C��ȷ��D����������ˮ���룬���������ӵ��δٽ�ˮ���룬C������ΪNaCl��A������Ϊ�����ƣ��ٽ�ˮ���룬��������ͬ�¶��£�C��ˮ�����c(H+)С��A��ˮ�����c(H+)����D������ѡD��


 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������Ԥ��ʵ��Ŀ�Ļ�����ʵ�����һ�µ���![]()
ѡ�� | ʵ����� | ʵ��Ŀ�Ļ���� |
A | �������� | ��ȥ |
B | ��ij��Һ�м��� | ֤����Һ�к� |
C | ��ij��Һ�м���ϡ���ᣬ�ų���ɫ��ζ���壬������ͨ�����ʯ��ˮ��ʯ��ˮ����� | ֤������Һ�д��� |
D | �� | ֤�� |
A.AB.BC.CD.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ŧ�۵�����ִ�������Ӧ�ù㷺����һ����п��أ���缫�ֱ���Ag2O��Zn���������ҺΪKOH��Һ���ܷ�Ӧ��Zn��Ag2O��ZnO��2Ag��

��ش��������⡣
(1)�õ������_________���(����һ��������������)��
(2)������_________���缫��Ӧʽ��__________________________��
(3)ʹ��ʱ����������pH_________(����������������С������������)��
(4)��ʵ֤��������Ƴ�ԭ��صķ�Ӧͨ���Ƿ��ȷ�Ӧ�����л�ѧ��Ӧ�������Ͽ�����Ƴ�ԭ��ص���_____��(����ĸ)
A.C(s)+H2O(g)=CO(g)+H2(g)����H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)����H<0
C.2CO(g)+O2(g)=2CO2(1)����H<0
(5)��KOH��ҺΪ�������Һ��������ѡ��Ӧ���һ��ԭ��أ��为���ĵ缫��ӦʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ��ѧ���Ķ��Ѻ��γ��ǻ�ѧ��Ӧ�������仯����Ҫԭ��
B. ��֪������Ksp[Mg(OH)2]=1.8��10-11����Mg(OH)2��pH=12��NaOH��Һ�е��ܽ��ԼΪ1.044��10-6g
C. ˮ�ܣ����ܡ����������ǿ�������Դ��ú��ʯ�͡���Ȼ���Dz���������Դ
D. �÷�ȩ��֬�Ƴɵ����Ͽɷ����������ڼӹ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�¶��£���������ʹ���������Һ�ıȽϣ�����˵����ȷ����
A.pH��ȵ�����Һ��c(CH3COO-)=c(Cl-)
B.��Ũ�ȵ�����ʹ����к���ͬ���ʵ�����NaOHʱ����������С
C.ͬpHֵʱ��ϡ����ͬ����������Һ��pHֵ��
D.��pHֵ������ʹ��������۷�Ӧ��������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���25��ʱijЩ�ε�Ũ�Ȼ�����������ĵ���ƽ�ⳣ��������˵����ȷ����
��ѧʽ | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp��Ka | Ksp=1.8��10-10 | Ksp=2.0��10-12 | Ka=1.8��10-5 | Ka=3.0��10-8 | Ka1=4.1��10-7 Ka2=5.6��10-11 |
A. ��ͬŨ��CH3COONa��NaClO�Ļ��Һ�У�������Ũ�ȵĴ�С��ϵ��c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. ��Ũ�Ⱦ�Ϊl��10-3mol/L��KCl��K2CrO4���Һ�еμ�l��10-3mol/LAgNO3��Һ��CrO42-���γɳ���
C. ̼������Һ�еμ�������ˮ�����ӷ���ʽΪCO32-+Cl2+H2O=HCO3-+Cl-+HClO
D. ��0.1mol/LCH3COOH��Һ�еμ�NaOH��Һ��c(CH3COOH):c(CH3COO-)=5:9����ʱ��ҺpH=5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������NaI��Һ��ͨ������Cl2�õ������Һ�������ú����Һ��ȡNaI���壬ʵ���������£�

��֪��Ӧ����2I��+2Cu2++![]() +H2O
+H2O![]() 2CuI��+
2CuI��+![]() +2H+��
+2H+��
�ش��������⣺
��1������ʵ������Ҫ�IJ�����������ͨ©�����ձ���_____________��
��2����Ӧ����CuI����������ԭ����ֻ��NO2���÷�Ӧ�Ļ�ѧ����ʽΪ_________________������95.5 g CuI���뷴Ӧ������Ҫ�����______________L��O2���ܽ����ɵ�NO2��ˮ����ȫת��Ϊ���ᡣ
��3��������B�к�����Ԫ�أ���ԭ������һ��Ԫ��ԭ�ӵ����ʵ���֮��Ϊ3��8������B�Ļ�ѧʽΪ_____________��
��4����Ӧ�������ɺ�ɫ�������ɫ���壬��ɫ������׳�Ϊ��������������Ӧ���Ļ�ѧ����ʽΪ______��
��5����������Cl2ͨ�뺬12 g NaI����Һ�У�һ��ʱ������Һ���ɵõ����������Ϊ_________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ����̼���������ܹ�ע��![]() �IJ�������Ч�������ó�Ϊ��ѧ���о�����Ҫ���⡣
�IJ�������Ч�������ó�Ϊ��ѧ���о�����Ҫ���⡣

(1)����β����������Ҫԭ��Ϊ![]() �����ܱ������з����÷�Ӧʱ��
�����ܱ������з����÷�Ӧʱ��![]() ���¶�
���¶�![]() �����������
�����������![]() ��ʱ��
��ʱ��![]() �ı仯������ͼ1ʾ���ݴ��жϣ�
�ı仯������ͼ1ʾ���ݴ��жϣ�
�ٸ÷�Ӧ��![]() ______
______![]() ����
����![]() ������
������![]() ��
��![]() ��
��
����![]() �¶��£�
�¶��£�![]() �ڵ�ƽ����Ӧ����
�ڵ�ƽ����Ӧ����![]() ______
______![]() ��
��
�۵��������������һ��ʱ������������������ѧ��Ӧ���ʡ��������ı����![]() ���ڴ����Ӧͼ�л���
���ڴ����Ӧͼ�л���![]() ��
��![]() ��
��![]() �����´ﵽƽ������еı仯����_____��
�����´ﵽƽ������еı仯����_____��
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ͼ2��ȷ����˵����Ӧ�ڽ��е�![]() ʱ�̴ﵽƽ��״̬����______
ʱ�̴ﵽƽ��״̬����______![]() �����
�����![]() ��
��
(2)ֱ���ŷ�úȼ�ղ������������������صĻ������⡣
��úȼ�ղ����������������������![]() ����ԭ
����ԭ![]() �������������������Ⱦ��
�������������������Ⱦ��
���磺![]()
![]()
д��![]() ����ԭ
����ԭ![]() ����
����![]() ��
��![]() ��
��![]() ���Ȼ�ѧ����ʽ��______��
���Ȼ�ѧ����ʽ��______��
�ڽ�ȼú�����Ķ�����̼�������ã��ɴﵽ��̼�ŷŵ�Ŀ�ġ���ͼ3ͨ���˹�������ã���![]() ��
��![]() Ϊԭ���Ʊ�HCOOH��
Ϊԭ���Ʊ�HCOOH��![]() ��ԭ��ʾ��ͼ������b���淢���ĵ缫��ӦΪ______
��ԭ��ʾ��ͼ������b���淢���ĵ缫��ӦΪ______
�۳�����![]() ��HCOONa��ҺpHΪ10����HCOOH�ĵ��볣��
��HCOONa��ҺpHΪ10����HCOOH�ĵ��볣��![]() ______
______![]() ��д���ռ�����
��д���ռ�����![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ������ͼ��ʾ��ͬ�¶���ˮ��Һ��c(H��)��c(OH��)�Ĺ�ϵ�������ж���ȷ����( )
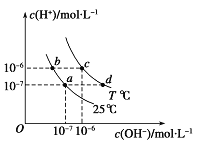
A.������������������c (H��) ��c (OH��)��Kw
B.T<25��
C.b���c��pH��Ϊ6����Һ������
D.ֻ�������µķ�ʽ������a����d��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com