
【化学—选修3 物质结构与性质】(15分)
(15分)已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
 (1) 元素A简单氢化物中A原子的杂化类型是________,B、C、D的电负性由小到大的顺序为______(用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是____________________。
(1) 元素A简单氢化物中A原子的杂化类型是________,B、C、D的电负性由小到大的顺序为______(用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是____________________。
(2)E原子的基态电子排布式为________。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如右图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为____________。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:________。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________。
(5)温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2。若有1 mol CH4生成,则有________mol σ键和________mol π键断裂。
解析:由题干信息可知,五种元素分别是:A-N B-Na C-F D-Cl E-Cu
(1)元素A简单氢化物是NH3,NH3中N采取sp3杂化,
(2)用切割法计算图a和b中的Cu原子
(3)晶格能越大熔点越高
(4)V2O5中V 没有未成对电子,CrO2中Cr含有2个未成对电子
(5)CO2中有2个σ键和2个π键,4H2有4个σ键
【答案】(1)sp3(1分) Na<Cl<F(2分) NaF(1分) HF和H2O分子之间能形成氢键(2分)
(2)1S22S22P63S23d104S1或〔Ar〕3d104S1(2分) 2∶1(2分)
(3)TiN>MgO>CaO>KCl(2分)
(4)CrO2(1分)
(5)6(1分) 2(1分)


科目:高中化学 来源: 题型:
下列现象或事实可用同一原理解释的是( )
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.氯水和活性炭使红墨水褪色
C.漂白粉和水玻璃长期暴露在空气中变质
D.二氧化碳和二氧化硫都能使澄清石灰水变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
在实验室中保存下列药品的方法,正确的是 ( )
A.氢氟酸可以用玻璃试剂瓶保存
B.浓硫酸盛放在广口瓶中
C.在同一层药品橱里存入浓氨水和浓盐酸
D.盛放硅酸钠水溶液的试剂瓶应用橡皮塞
查看答案和解析>>
科目:高中化学 来源: 题型:
将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000 mL,测得c(Cu2+)=0.3 mol/L。试计算:
(1)反应过程中放出的气体在标准状况下的体积(不考虑气体在溶液中的溶解)?
(2)溶液稀释后,c(H+)是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的pH=1,下列叙述不正确的是( )
A.气体甲中SO2与H2的体积比为4:1
B.反应中共消耗1.8 mol H2SO4
C.反应中共消耗97.5 g Zn
D.反应中共转移3 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:①101 时,
时,
②稀溶液中: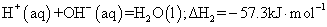
下列说中正确的是
A、若碳的燃烧热用 表示,则B、若碳的燃烧热用
表示,则B、若碳的燃烧热用 表示,则
表示,则
C、浓硫酸与稀 溶液反应的中和热值为57.3kJ·mol-1
溶液反应的中和热值为57.3kJ·mol-1
D、稀醋酸与稀 溶液反应生成1mol水,放出57.3kJ的热量
溶液反应生成1mol水,放出57.3kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
一种海水电池的反应原理可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,有关该反应的说法正确的是( )
A.反应中MnO2是还原剂 B.Ag的还原性比Na2Mn5O10强
C.该反应中MnO2具有催化作用 D.每生成1 mol Na2Mn5O10转移1 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
在稀氨水中存在下述电离平衡NH3+H2O  NH3 ·H2O
NH3 ·H2O  NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
| 加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
| c(OH-)的变化 | |||
| 平衡移动方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素A、B、C、D,原子序数依次增大;A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是( )
A、原子半径:A<B<C<D B、非金属性:A>C
C、最高价氧化物对应水化物的酸性:D<C D、单质B在常温下能溶于浓硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com