
【题目】25℃时,将浓度均为0.1 mol/L、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是
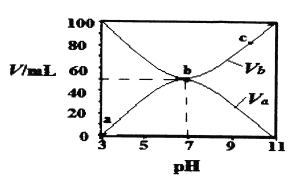
A. Ka(HA)=10-6mol·L-l
B. b点时,c(B+)=c(A-)=c(H+)=c(OH-)
C. b→c过程中,![]() 随温度升高而增大
随温度升高而增大
D. a→c过程中水的电离程度始终增大
【答案】C
【解析】A、开始时,0.1mol·L-1HA溶液的pH=3,说明HA为弱酸,同理BOH为弱碱,HA![]() H++A-,c(H+)=c(A-)=10-3mol·L-1,弱电解质的电离微弱,c(HA)约为0.1mol·L-1,根据电离平衡常数的表达式,Ka=10-6×10-6/0.1=10-11,故A错误;B、b点时pH=7,根据电荷守恒,即有c(B-)=c(A+)>c(H+)=c(OH-),故B错误;C、,在b点pH=7,此时的溶质为BA,说明B+水解的程度等于A-水解的程度,b→c过程中,c溶质为BA和BOH,bc段溶液显碱性,是BOH电离的缘故,BOH为弱碱,升高温度,促进电离,c(OH-)增大,对A-+H2O
H++A-,c(H+)=c(A-)=10-3mol·L-1,弱电解质的电离微弱,c(HA)约为0.1mol·L-1,根据电离平衡常数的表达式,Ka=10-6×10-6/0.1=10-11,故A错误;B、b点时pH=7,根据电荷守恒,即有c(B-)=c(A+)>c(H+)=c(OH-),故B错误;C、,在b点pH=7,此时的溶质为BA,说明B+水解的程度等于A-水解的程度,b→c过程中,c溶质为BA和BOH,bc段溶液显碱性,是BOH电离的缘故,BOH为弱碱,升高温度,促进电离,c(OH-)增大,对A-+H2O![]() HA+OH-抑制,c(A-)增大,c(HA)减小,因此c(A-)/c(HA)随着温度的升高而增大,故C正确;D、酸或碱抑制水的电离,盐类水解促进水的电离,因此b点水电离出的c(H+)>10-7mol·L-1,而a、c两点水的电离出的c(H+)<10-7mol·L-1,故D错误。
HA+OH-抑制,c(A-)增大,c(HA)减小,因此c(A-)/c(HA)随着温度的升高而增大,故C正确;D、酸或碱抑制水的电离,盐类水解促进水的电离,因此b点水电离出的c(H+)>10-7mol·L-1,而a、c两点水的电离出的c(H+)<10-7mol·L-1,故D错误。


科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是
A.分离溴苯与苯:用分液漏斗分液
B.萃取溴水中的溴:向溴水中加入己烷
C.制硝基苯:将苯、浓硝酸、浓硫酸的混合液用酒精灯加热
D.制取溴苯:将铁屑、溴水、苯混合加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3H、14C、14N、16O、32S等在科学研究中应用广泛,下列对它们的说法正确的是( )
A.3H的核外电子数比2H多一个
B.16O和32S原子核内的中子数相等
C.14C和14N互称为同位素
D.32S原子核内的质子数为16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行了探究。己知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g)CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应②是_______(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示);根据反应③判断△S_______(填“>”“=”或“<”)0,在_______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有______(填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g的浓度分别为 0.1mol/L、0.8 mol/L、0.3 mol/L、0.15 mol/L,则此时v(正)_______v(逆) (填“>”“=”或“<”)。
(5)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升高温度,t1时平衡,t2时减小压强,t3时增大CO的浓度,t4时又达到平衡。在下图中画出t2至t4的曲线。_____

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和锌的混合物共31.6克,与足量稀硫酸反应,产生标准状况下氢气11.2 升,
问:①产生标准状况下氢气的物质的量是多少?__________
②混合物中锌的物质的量是多少___________?铁的质量是多少?___________
③参与反应的硫酸物质的量是多少?_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A2 + 3B2![]() 2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
A.v(B2) =0.8mol(Ls)-1 B.v(A2) =0.4 mol(Ls)-1
C.v(C) =0.6 mol(Ls)-1 D.v(D) =0.1 mol(Ls)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A. CO32-+H2O![]() HCO3-+OH-:用热的纯碱溶液清洗油污
HCO3-+OH-:用热的纯碱溶液清洗油污
B. A13++3H2O![]() Al(OH)3(胶体)+3H+:明矾净水
Al(OH)3(胶体)+3H+:明矾净水
C. TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl:制备TiO2纳米粉
TiO2·xH2O↓+4HCl:制备TiO2纳米粉
D. SnCl2+H2O![]() Sn( OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液
Sn( OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq) + Cu(s) ="=" Cu2+(aq) + 2Ag(s)设计的原电池如图所示。
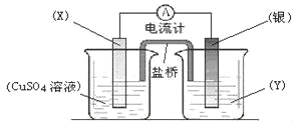
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在80 g密度为d g/cm3的硫酸铁溶液中,含有2.8 g Fe3+离子,则此溶液中SO42-的物质的量浓度为_____________
(2)由N2和CO2组成的混合气体的密度在同温、同压下是氢气密度的16倍,则该混合气体中N2和CO2的体积比为_______________________
(3)标准状况下,1.12LNOx气体质量为2.3g,则x的值为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com