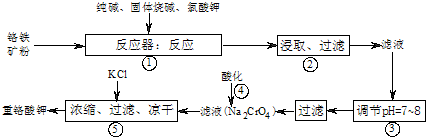
工业上常用铬铁矿(有效成份为FeO?Cr
2O
3,主要杂质为SiO
2、Al
2O
3)为原料生产重铬酸钾(K
2Cr
2O
7),实验室模拟工业法用铬铁矿制重铬酸钾的主要工艺流程如图所示,涉及的主要反应是:6FeO?Cr
2O
3+24NaOH+7KClO
312Na
2CrO
4+3Fe
2O
3+7KCl+12H
2O,试回答下列问题:

(1)⑤中溶液金属阳离子的检验方法是
.
(2)步骤③被沉淀的离子为(填离子符号)
.
(3)在反应器①中,二氧化硅与纯碱反应的化学方程式为:
.
(4)烟道气中的CO
2可与H
2合成甲醇.CH
3OH、H
2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO
2、H
2合成CH
3OH的热化学方程式:
.
(5)2011年云南曲靖的铬污染事件,说明含铬废渣(废水)的随意排放对人类生存环境有极大的危害.电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr
2O
72-的酸性废水,一段时间后产生Fe(OH)
3和Cr(OH)
3沉淀.
①写出电解法处理废水的总反应的离子方程式
.
②已知Cr(OH)
3的K
sp=6.3×10
-31,若地表水铬含量最高限值是0.1mg/L,要使溶液中c(Cr
3+)降到符合地表水限值,须调节溶液的c(OH
-)≥
mol/L(只写计算表达式).





 HSiO3-+OH-、HSiO3-+H2O
HSiO3-+OH-、HSiO3-+H2O H2SiO3+OH-、AlO2-+2H2O
H2SiO3+OH-、AlO2-+2H2O Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀
Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀 HSiO3-+OH-、HSiO3-+H2O
HSiO3-+OH-、HSiO3-+H2O H2SiO3+OH-、AlO2-+2H2O
H2SiO3+OH-、AlO2-+2H2O Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀
Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀