
����Ŀ��������ѧ֪ʶ�ش��������⣺
��1�������ӷ���ʽ��ʾ�μ�������϶�Na2CO3���ʼ��Ե�ԭ��____________����ͬŨ�ȵ�Na2CO3��Һ��NaHCO3��Һ�������Ϻ���Һ��c��HCO3-�� ____c��CO32-�����á���������=����ʾ����
��2������ʱ��AlCl3��Һ��____������ᡱ��������С�������AlCl3��Һ���ɣ����գ��õ��Ĺ��������________��AlCl3��Һ��NaHCO3��Һ���ʱ������Ӧ�����ӷ���ʽΪ____________________��
���𰸡���1��CO32-��H2O![]() HCO3-��OH-�� �� ����2���Al2O3��Al3+��3HCO3-��Al��OH��3����3CO2����
HCO3-��OH-�� �� ����2���Al2O3��Al3+��3HCO3-��Al��OH��3����3CO2����
��������
�����������1��Na2CO3����ǿ�������Σ�CO32������ˮ�⣬CO32����H2O![]() HCO3����OH����HCO3����H2O
HCO3����OH����HCO3����H2O![]() H2CO3��OH������������ˮ����ɣ�Խ��Խˮ�⣬CO32��ˮ����������HCO3����ˮ����������c��CO32������c��HCO3��������2��AlCl3����ǿ�������Σ�������ˮ�⡢˭ǿ��˭�ԣ���ˮ��Һ�����ԣ�AlCl3��3H2O
H2CO3��OH������������ˮ����ɣ�Խ��Խˮ�⣬CO32��ˮ����������HCO3����ˮ����������c��CO32������c��HCO3��������2��AlCl3����ǿ�������Σ�������ˮ�⡢˭ǿ��˭�ԣ���ˮ��Һ�����ԣ�AlCl3��3H2O![]() Al��OH��3��3HCl������HCl�ӷ����ٽ�ˮ�⣬�õ������������������������ֽ����������ˮ�����߷���˫ˮ�⣬���ӷ�Ӧ����ʽΪ��Al3+��3HCO3-��Al��OH��3����3CO2����
Al��OH��3��3HCl������HCl�ӷ����ٽ�ˮ�⣬�õ������������������������ֽ����������ˮ�����߷���˫ˮ�⣬���ӷ�Ӧ����ʽΪ��Al3+��3HCO3-��Al��OH��3����3CO2����


 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CoCl2��6H2O��һ������Ӫ��ǿ������һ������ˮ�ܿ�(��Ҫ�ɷ�ΪCo2O3��Co(OH)3����������Fe2O3��Al2O3��MnO��)��ȡCoCl2��6H2O�Ĺ����������£�

��֪��������Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Al3+�ȣ�
������������������������ʽ����ʱ��Һ��pH���±���(��������Ũ��Ϊ��0.01mol/L)
������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
��ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
��CoCl2��6H2O�۵�Ϊ86����������110~120��ʱ��ʧȥ�ᾧˮ������ˮ�Ȼ��ܡ�
��1��д������������Co2O3������Ӧ�����ӷ���ʽ ��
��2��д��NaClO3������Ӧ����Ҫ���ӷ���ʽ ����������������Һ���мӹ���NaClO3ʱ�����ܻ������ж����壬д�����ɸ��ж���������ӷ���ʽ ��
��3������Na2CO3��pH��a��,�������õ��ij����ɷ�Ϊ ��
��4��������1���а���3������ʵ����������������� �� ���ˡ��Ƶõ�CoCl2��6H2O�ں��ʱ���ѹ��ɵ�ԭ���� ��
��5����ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��ͼ��������Һ���м�����ȡ����Ŀ���� ����ʹ�õ����pH��Χ�� ��
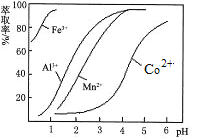
A��2.0~2.5 B��3.0~3.5
C��4.0~4.5 D��5.0~5.5
��6��Ϊ�ⶨ�ֲ�Ʒ��CoCl2��6H2O��������ȡһ�������Ĵֲ�Ʒ����ˮ����������AgNO3��Һ�����ˡ�ϴ�ӣ���������ɺ����������ͨ�����㷢�ֲִ�Ʒ��CoCl2��6H2O��������������100������ԭ������� ��(��һ������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�230Th��232Th��˵����ȷ����
A��230Th��232Th�ĺ����������ͬ
B��230Th��232Th�Ļ�ѧ���ʲ�ͬ
C��230Th��232Th��Ϊͬλ��
D��230Th��232Th��ͬһ�ֺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���������ɱ��Ӻͼ�ȩ�����Ϸ�Ӧ�����ɵ�һ�״��������������״��ϣ��ʥ�����ƣ������ɶ���������ɵķ�������ӣ��ɴ˵�����������������[n]����������ʽ������n�Ƿ�������Ŀ����ͼ��ʾ�����嶡��[��C(CH3)3]ȡ���ı�[n]�����Ľṹ��ʽ��

�ش��������⣺
��1����[n]������ͨʽ�ǣ� ��
��2�����嶡��ȡ���ı�[n]�����ڹ�������º�������Ӧʱ��ȡ�������ϵ���ͷ��ǻ��ϵ��⣬����һ�ȴ����� �֣��������嶡��ȡ���ı�[2015]���������������£�����ȴ����� �֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����գ�
��1���ǻ��ĵ���ʽ ��
��2����Է�������Ϊ72�ҷе���͵������Ľṹ��ʽ ��
��3���ϳɸ߾���![]() �䵥��ļ���ʽ ��
�䵥��ļ���ʽ ��
��4��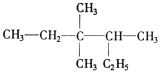 �����ƣ�ϵͳ�������� ��
�����ƣ�ϵͳ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�����ö������棨CeO2����̫���������½�H2O��CO2ת���H2��CO����������£�����˵������ȷ����


A. �ù�����CeO2û������
B. �ù���ʵ����̫������ѧ�ܵ�ת��
C. ��ͼ�С�H1=��H2+��H3
D. ��CO��O2���ɵļ���ȼ�ϵ�صĸ�����ӦʽΪ��CO+4OH��- 2e��=CO32��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С����Ƴ����ù�ҵ��������10%��H2SO4���ͷ�������ͭп����ȡ����ZnO�ķ�����ͼ��
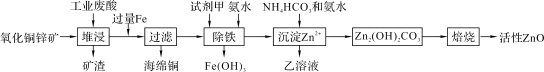
��֪��298 Kʱ�����ӿ�ʼ��������ȫ����ʱ��pH���±���ʾ��
���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
��ش��������⣺
��1����H2SO4�����¿�ʯ�к��е�ZnS�ܽ��CuS���ܣ�����������ͬ�¶��£�Ksp��CuS��____Ksp��ZnS����ѡ���������������������
��2�������������Լ������ѡ��____�����������
A��KMnO4 B��H2O2 C��HNO3 D��Cl2
��3�����������м��백ˮ��Ŀ���ǵ���pH��____��Χ֮�䡣
��4����д������Zn2+ʱ������Ӧ�����ӷ���ʽ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������һ����Ҫ�ķǽ������ϣ��Ʊ��������Ҫ�������£�
�ٸ������ù�����̼��ԭ���������Ƶôֹ裬ͬʱ�õ�һ�ֿ�ȼ�����壻
�� �ֹ�������HCl���巴Ӧ�Ƶ�SiCl3��Si+ 3HCl![]() SiCl3 + H2��
SiCl3 + H2��
�� SiHC13�������H2��1100��1200����¶��·�Ӧ�Ƶô��裬��֪SiHCi3������ˮ���ҷ�Ӧ���ڿ���������ȼ��
��ش�
��1����һ����ȡ�ֹ�Ļ�ѧ��Ӧ����ʽΪ_________��
��2���ֹ���HCl���巴Ӧ��ȫ�������õ���SiHCl3���е�33.0�� ���к�������SiC14 ���е�57.6������HCl���е�-84.7�������ᴿSiHC13���õķ���Ϊ________��
��3��ʵ������SiHCl3 �������H2��Ӧ��ȡ����װ����ͼ��ʾ�����Ⱥͼг�װ����ȥ����

��װ��B�е��Լ���___________��װ��C�е��ձ���Ҫ���ȣ�Ŀ����___________��
�ڷ�Ӧһ��ʱ���װ��D�й۲쵽��������___________��װ��D���ܲ�����ͨ�����ܵ�ԭ����___________��װ��D�з�����Ӧ�Ļ�ѧ����ʽ��___________��
��Ϊ��֤�Ʊ�����ʵ��ijɹ��������Ĺؼ��Ǽ��ʵ��װ�õ������ԣ����ƺ÷�Ӧ�¶��Լ�___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���밴Ҫ�����
��1�����ĵ���ʽ ��ʯ���Ľṹʽ ___________________
��2��д�������л����ϵͳ������CH3CH��C2H5��CH��CH3��2______
��3��д�����и����л���Ľṹ��ʽ��
��2��3��������4���һ����� ��
��֧��ֻ��һ���һ���ʽ����С������ ��
��4�����ȼ��2��8gij�л���A������8��8g CO2��3��6g H2O�������л�������������ܶ�����ͬ������N2��2����
������л���ķ���ʽ ��
�����л�����״ͬ���칹��Ľṹ��ʽΪ�� �� �� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com