
【题目】在容积为1 L的容器中,通入一定量的N2O4,发生反应N2O4(g) ![]() 2NO2(g),若升高体系温度,则混合气体的颜色将变深。实验测得,保持体系温度为100 ℃,体系中各物质的浓度随时间的变化如图所示;90 s后,将体系温度改为T ℃,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s重新达到平衡。
2NO2(g),若升高体系温度,则混合气体的颜色将变深。实验测得,保持体系温度为100 ℃,体系中各物质的浓度随时间的变化如图所示;90 s后,将体系温度改为T ℃,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s重新达到平衡。
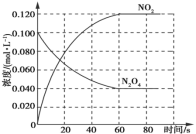
下列说法错误的是( )
A.0~60 s时段内,平均反应速率v(NO2)=0.002 0 mol·L-1·s-1
B.60 s后,体系温度保持100 ℃,则混合气体的平均相对分子质量保持不变
C.T ℃>100 ℃,第100 s时,c(N2O4)=0.020 mol·L-1
D.100 s后,在T ℃将容器体积缩小为0.5 L,则正反应速率减小,逆反应速率增大
【答案】D
【解析】
A. 根据图像0~60 s时段,NO2的物质的量浓度变化为0.120 mol·L-1,根据公式v=![]() =
= ![]() =0.002 0 mol·L-1·s-1,故A正确;
=0.002 0 mol·L-1·s-1,故A正确;
B. 60 s后,体系温度保持100 ℃,由图可知,NO2和N2O4的浓度不在变化,说明反应达到平衡状态,混合气体的平均相对分子质量保持不变,故B正确;
C.将体系温度改为T ℃,10s后达到平衡,平衡时c(N2O4)=0.04mol L-1-0.002 mol L-1 s-1×10s=0.020 mol·L-1,故C正确;
D. 温度T时反应达到平衡后,将反应容器的容积减小一半,压强增大,平衡会向气体体积减小的方向移动,该反应逆反应为气体体积减小的反应,故平衡向逆反应方向移动。同时正逆反应速率都增大,故D错误;
题目要求选择错误的,故选D。


科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
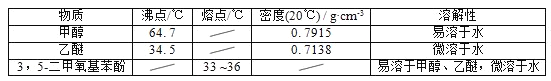
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A. Z为0.2 mol·L-1 B. Y2为0.35 mol·L-1
C. X2为0.3 mol·L-1 D. Z为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Co、Cu、Zn都是过渡元素,可作为中心原子形成多种配合物,下列不能作为配合物配位体的是______;
A.H2O B.NH3 C.CH4 D.Cl﹣
(2)用氢键表示式写出氨水中NH3分子与水分子间可能存在的氢键____;
(3)Cu元素可形成[Cu(NH3)4]SO4,其中存在的化学键类型有______(填序号);
①配位键 ②氢键 ③极性共价键 ④非极性共价键 ⑤离子键
(4)甲烷晶体的晶胞结构如下图,下列有关说法正确的是_______。
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C.CH4晶体熔化时需克服共价键

(5)下图表示的是SiO2的晶胞结构(白圈代表硅原子,黑点代表氧原子),判断在30g二氧化硅晶体中含______mol Si-O键。如果该立方体的边长为a cm,用NA 表示阿伏加德罗常数,则SiO2晶体的密度表达式为__________________g/cm3 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分。已知a原子的最外层电子数比次外层电子数少3,下列说法中不正确的是
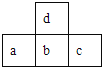
A. 元素c的含氧酸一定是强酸
B. 元素a、d的原子半径:a>d
C. 元素b在自然界中存在游离态
D. 元素b、c的阴离子半径:b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向30 mL 1 mol·L-1的AlCl3溶液中逐渐加入浓度为4 mol·L-1的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为( )
A.3 mLB.7.5 mLC.15 mLD.17.5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为_____,该能层具有的原子轨道数为_____.
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是_____,B原子的杂化轨道类型是_____.
Li、B、H元素的电负性由大到小排列顺序为_____.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+_____H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
I1/kJmol﹣1 | I2/kJmol﹣1 | I3/kJmol﹣1 | I4/kJmol﹣1 | I5/kJmol﹣1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____(填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为_____,NaH的理论密度是___________gcm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以N2和H2为反应物,盐酸酸化的NH4Cl溶液为电解质的原电池,工作原理如图所示,下列说法不正确的是

A.b电极为负极
B.反应过程中,溶液中的H+向a电极移动
C.a电极的电极反应式为N2+6e-+8H+=2NH![]()
D.放电一段时间之后,溶液的酸性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com