
【题目】膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。

(1)A装置是________(填“原电池”或“电解池”),A装置中通入SO2一极的电极反应式为________________________________________。
(2)N2O5在电解池的________(填“c极”或“d极”)区生成,其电极反应式为____________。
【答案】原电池 SO2-2e-+2H2O=SO42-+4H+ c极 N2O4-2e-+2HNO3=2N2O5+2H+
【解析】
A池没有外接电源,是自发进行的氧化还原反应,B池中两电极都是惰性电极,则A池为原电池,a电极发生失电子的氧化反应,为负极,b电极为正极;B池为电解池,与正极相连的c电极为阳极,与负极相连的d电极为阴极。
(1) A装置中通入SO2一极为负极,SO2失电子转化为H2SO4。
(2)N2O5在电解池中由N2O4失电子生成,发生反应为N2O4失电子,与HNO3结合,生成N2O5等。
(1)通过以上分析,可得出A装置是原电池,A装置中通入SO2一极为负极,电极反应式为SO2-2e-+2H2O=SO42-+4H+。答案为:原电池;SO2-2e-+2H2O=SO42-+4H+;
(2)通过分析可知,N2O5由N2O4失电子生成,则在电解池的阳极即c极区生成,其电极反应式为N2O4-2e-+2HNO3=2N2O5+2H+。答案为:c极;N2O4-2e-+2HNO3=2N2O5+2H+。


科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( )
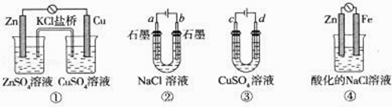
A. 装置①中,盐桥中的K+移向ZnSO4溶液
B. 滴有酚酞溶液的装置②在电解过程中,b极先变红
C. 可以用装置③在铁上镀铜,d极为铜
D. 装置④中发生铁的吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是 ( )
A.钢铁腐蚀时可能发生的负极反应:2H2O +O2 +4e-=4OH-
B.明矾水解的离子方程式:A13++3H2O ![]() Al(OH)3+3H+
Al(OH)3+3H+
C.氢氧化钙溶液与碳酸氢钠溶液混合:OH-+HCO3-=H2O +CO32-
D.可表示氢气燃烧的热化学方程式:2H2 (g)+O2 (g)=2H2O (1);△H= +571.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月在法国凡尔赛召开了国际计量大会,会议将阿伏加德罗常数的定义修改为“1摩尔包含6.02214076×1023个基本单元,这一常数被称为阿伏加德罗常数,单位为mol-1”。若NA表示阿伏加德罗常数的值,则下列说法错误的是
A. 新定义中阿伏加德罗常数的不确定度被消除
B. 常温常压下,11.2LO2与N2组成的混合气体,含有原子个数小于NA
C. 117号元素符号为Ts(中文名![]() ),其重氢化物D293Ts含有中子数为177NA
),其重氢化物D293Ts含有中子数为177NA
D. 60.0gC3H8O中含有的C-C键可能小于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=11的X、Y两种碱溶液各10mL,分别稀释至1000mL。其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
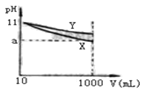
A. X、Y两种碱的物质的量浓度一定相等
B. 稀释后,X溶液碱性比Y溶液碱性强
C. 若9<a<11,则X、Y都是弱碱
D. 完全中和X、Y两溶液时,消耗同浓度盐酸的体积VX>VY
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据所学知识回答下列问题:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1_______△H2(填“>”、“<”或“=”,下同)。
(2)已知常温时红磷比白磷稳定,比较下列反应中△H的大小:△H1_______△H2。
①P4(白磷,s)+5O2(g)=2P2O5(s) △H1
②4P(红磷,s)+5O2(g)=2P2O5(s) △H2
(3)已知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量__________57.3kJ。
(4)已知:0.5 mol CH4(g)与0.5 mol水蒸气在t℃、pkPa时,完全反应生成CO和H2的混合气体,吸收了a kJ热量,该反应的热化学方程式是___________________________________。
(5)氨气是一种重要的物质,可用于制取化肥和硝酸等。已知H-H键、N-H键、N≡N键的键能分别是436 kJ·mol-1、391 kJ·mol-1、946 kJ·mol-1。写出合成氨的热反应方程式:___________________________________。生成1 mol NH3需要吸收或放出________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
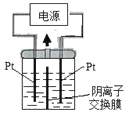
已知:3I2+6OH—=IO3—+5I—+3H2O
下列说法不正确的是
A. 右侧发生的电极方程式:2H2O+2e—=H2↑+2OH—
B. 电解结束时,右侧溶液中含有IO3—
C. 电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MoS2(s)(辉钼矿的主要成分可用于制取钼的化合物、润滑添加剂、氢化反应和异构化反应的催化剂等,回答下列问题:
(1)已知:MoS2(s)=Mo(s)+S2(g) △H1;
S2(g)+2O2(g)=2SO2(g) △H2;
2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) △H3;;
反应2Mo(s)+3O2(g)=2MoO3(s)的△H=______用含△H1、△H2、△H3的代数式表示
(2)利用电解法可浸取辉钼矿得到Na2MoO4和Na2SO4溶液装置如图所示。
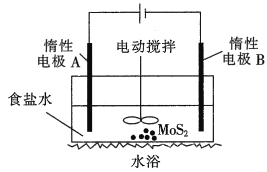
①阴极的电极反应式为__________。
②MoO42-在电极______(填A或B)附近生成。
③实际生产中,惰性电极A一般不选用石墨,而采用DSA惰性阳极(基层为TiO2,涂层为RuO2+IrO2),理由是_______________。
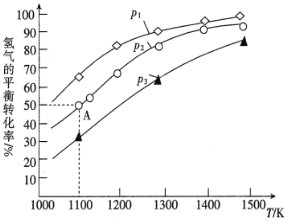
(3)用辉钼矿冶炼Mo的反应为MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。该反应的△H______0(填“>”或“<”);p1、p2、p3按从小到大的顺序为______________。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。该反应的△H______0(填“>”或“<”);p1、p2、p3按从小到大的顺序为______________。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若充入氦气,平衡 ________(填“向正反应方向”“向逆反应方向”或“不移动”)。
(5)在2L的恒温恒容密闭容器中加入0.1mol MoS2、0.2mol Na2CO3、0.4mol H2,在1100K时发生反应,达到平衡时恰好处于图中A点,则此温度下该反应的平衡常数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.10 mol/L CuCl2溶液中滴加0.10mol/L Na2S溶液,滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法正确的是

A. Ksp(CuS)的数量级为10-21
B. 曲线上a点溶液中,c(S2-)c(Cu2+) > Ksp(CuS)
C. a、b、c三点溶液中,n(H+)和n(OH-)的积最小的为b点
D. c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com