
【题目】下列用来表示物质变化的化学用语中,正确的是 ( )
A.钢铁腐蚀时可能发生的负极反应:2H2O +O2 +4e-=4OH-
B.明矾水解的离子方程式:A13++3H2O ![]() Al(OH)3+3H+
Al(OH)3+3H+
C.氢氧化钙溶液与碳酸氢钠溶液混合:OH-+HCO3-=H2O +CO32-
D.可表示氢气燃烧的热化学方程式:2H2 (g)+O2 (g)=2H2O (1);△H= +571.6kJ/mol
科目:高中化学 来源: 题型:
【题目】关于银镜反应的实验操作步骤如下:
A.在试管中先注入少量NaOH溶液,振荡,加热煮沸之后把NaOH溶液倒去,再用蒸馏水洗净试管备用
B.在洗净的试管里配制银氨溶液
C.向银氨溶液中滴入3~4滴乙醛稀溶液
D.加热
请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目的是_____________________________;
(2)简述银氨溶液的配制过程:__________________________________________;
(3)写出乙醛发生银镜反应的化学方程式:_____________________________________;
(4)银氨溶液久置可能会爆炸,直接排放会污染环境,且造成资源浪费,实验室从废液中回收银的实验流程如下:![]()
已知:[Ag(NH3)2]+![]() Ag++2NH3
Ag++2NH3
①写出废液与稀硝酸反应的离子方程式:__________________________________;
②加入铁粉要过量的目的是___________________________________________.
③该实验过程中可能产生的大气污染物是________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业上采用离子交换膜法电解足量饱和食盐水的示意图。下列有关说法中不正确的是( )
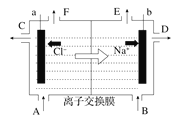
A.从E口逸出的是氢气
B.向B口中加入含少量NaOH的溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D.向电解后的阳极室溶液中加入适量盐酸,各物质可以恢复到电解前的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 是阿伏加德罗常数的值,下列说法正确的是
是阿伏加德罗常数的值,下列说法正确的是![]()
![]()
A.![]() 的乙醇溶液中,含
的乙醇溶液中,含![]() 键的数目为
键的数目为![]()
B.标准状况下,![]() 乙炔和苯的混合物中含
乙炔和苯的混合物中含![]() 键数目为
键数目为![]()
C.![]() 溶液中含
溶液中含![]() 数目为
数目为![]()
D.某温度下,![]() 的
的![]() 溶液中,水电离出的
溶液中,水电离出的![]() 总数为
总数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向2L的密闭容器中投入一定量的X和Y,在催化剂的作用下发生反应:X(g)+Y(g) 2Z(g)。反应过程中测定的部分数据如下表:
t/min | n(X)/mol | n(Y)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
下列说法正确的是
A.反应0~2min末的平均速率υ(Z)=0.2 mol/(L·min)
B.在2min~4min间,υ(X)正<υ(Y)逆
C.生成2 mol Z的同时消耗1 mol Y能说明该反应已达化学平衡状态
D.其他条件不变,再充入1.2 mol X和0.6 mol Y,X的转化率将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律在生产和科学研究中有很重要的意义。已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,放出了X kJ热量。已知碳完全燃烧的焓变△H= 一Y kJ·mol-1,则lmol C与O2反应生成CO的反应热△H为 ( ) kJ·mol-1
A.一Y B.—(10X—Y) C.一(5X—O.5Y) D.+(10X—Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。

(1)A装置是________(填“原电池”或“电解池”),A装置中通入SO2一极的电极反应式为________________________________________。
(2)N2O5在电解池的________(填“c极”或“d极”)区生成,其电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.在25℃、101KPa,1molS(s)和2molS(s)的燃烧热相等
B.1molH2SO4(浓)与1molBa(OH)2完全中和所放出等于中和热的数值
C.同温同压下,H2(g)+Cl2(g)![]() 2HCl(g)在光照和点燃条件下的△H不同
2HCl(g)在光照和点燃条件下的△H不同
D.图中的反应:逆反应的活化能小于正反应的活化能,由图可知催化剂可以改变反应的△H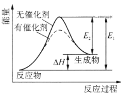
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com