
【题目】下列说法正确的是
A.在25℃、101KPa,1molS(s)和2molS(s)的燃烧热相等
B.1molH2SO4(浓)与1molBa(OH)2完全中和所放出等于中和热的数值
C.同温同压下,H2(g)+Cl2(g)![]() 2HCl(g)在光照和点燃条件下的△H不同
2HCl(g)在光照和点燃条件下的△H不同
D.图中的反应:逆反应的活化能小于正反应的活化能,由图可知催化剂可以改变反应的△H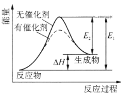
【答案】A
【解析】
A、根据燃烧热的定义:25℃、101KPa,1mol可燃物完全燃烧放出的热量,因此1molS(s)和2molS(s)的燃烧热是相等的,故A说法正确;
B、浓硫酸溶于水放出热量,且H2SO4与Ba(OH)2反应,存在SO42-+Ba2+=BaSO4↓,伴随能量的变化,因此1molH2SO4(浓)与1molBa(OH)2完全反应所放出热量大于中和热的数值,故B说法错误;
C、△H只与始态和终态有关,与反应条件无关,同温同压下,H2(g)+Cl2(g)![]() 2HCl(g)在光照和点燃条件下的△H是相同的,故C说法错误;
2HCl(g)在光照和点燃条件下的△H是相同的,故C说法错误;
D、使用催化剂可以改变活化能,不能改变△H,故D说法错误;
答案为A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是 ( )
A.钢铁腐蚀时可能发生的负极反应:2H2O +O2 +4e-=4OH-
B.明矾水解的离子方程式:A13++3H2O ![]() Al(OH)3+3H+
Al(OH)3+3H+
C.氢氧化钙溶液与碳酸氢钠溶液混合:OH-+HCO3-=H2O +CO32-
D.可表示氢气燃烧的热化学方程式:2H2 (g)+O2 (g)=2H2O (1);△H= +571.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
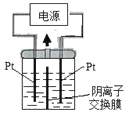
已知:3I2+6OH—=IO3—+5I—+3H2O
下列说法不正确的是
A. 右侧发生的电极方程式:2H2O+2e—=H2↑+2OH—
B. 电解结束时,右侧溶液中含有IO3—
C. 电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MoS2(s)(辉钼矿的主要成分可用于制取钼的化合物、润滑添加剂、氢化反应和异构化反应的催化剂等,回答下列问题:
(1)已知:MoS2(s)=Mo(s)+S2(g) △H1;
S2(g)+2O2(g)=2SO2(g) △H2;
2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) △H3;;
反应2Mo(s)+3O2(g)=2MoO3(s)的△H=______用含△H1、△H2、△H3的代数式表示
(2)利用电解法可浸取辉钼矿得到Na2MoO4和Na2SO4溶液装置如图所示。
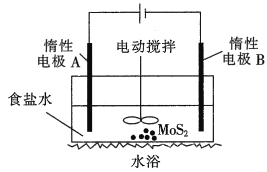
①阴极的电极反应式为__________。
②MoO42-在电极______(填A或B)附近生成。
③实际生产中,惰性电极A一般不选用石墨,而采用DSA惰性阳极(基层为TiO2,涂层为RuO2+IrO2),理由是_______________。
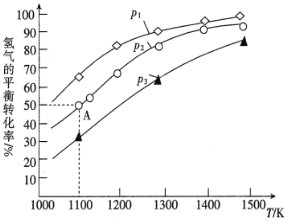
(3)用辉钼矿冶炼Mo的反应为MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。该反应的△H______0(填“>”或“<”);p1、p2、p3按从小到大的顺序为______________。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。该反应的△H______0(填“>”或“<”);p1、p2、p3按从小到大的顺序为______________。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若充入氦气,平衡 ________(填“向正反应方向”“向逆反应方向”或“不移动”)。
(5)在2L的恒温恒容密闭容器中加入0.1mol MoS2、0.2mol Na2CO3、0.4mol H2,在1100K时发生反应,达到平衡时恰好处于图中A点,则此温度下该反应的平衡常数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,AgCl的溶解平衡曲线如图所示。已知pAg=-lg c(Ag+)、pCl=-lg c(Cl-),利用pCl、pAg的坐标系可表示出AgCl的溶度积与溶液中c(Ag+)和c(Cl-)的相互关系。下列说法错误的是
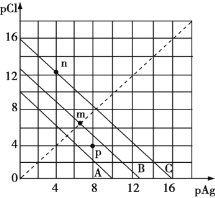
A. A线、B线、C线对应的温度关系:A>B>C
B. A线对应温度下,AgCl的Ksp=1×10-10
C. B线对应温度下,p点形成的溶液是AgCl的不饱和溶液
D. C线对应温度下,n点表示KCl与过量的AgNO3反应产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
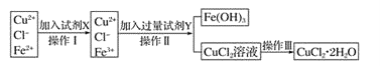
请参照下表给出的数据填空。

(1)操作I加入X的目的是___________________________ 。
(2)下列物质都可以作为X,适合本实验的X物质可以是_________(填字母)。
A KMnO4 B NaClO C H2O2 D Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)__________________________________________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,将C12缓慢通入100 mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1 mol·L-1 NaOH溶液,整个过程溶液中H+的浓度变化如图所示。(已知常温常压下C12溶于水时,只有部分C12会和水发生反应)下列叙述正确的是

A. ①处溶液的酸性比②处溶液的酸性强
B. 依据②处c(H+)可计算溶解的C12的物质的量
C. 整个实验过程中,溶液的颜色先变深后变浅,最后变为无色
D. ④处表示C12与NaOH溶液恰好完全反应,共转移了0.1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.10 mol/L CuCl2溶液中滴加0.10mol/L Na2S溶液,滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法正确的是

A. Ksp(CuS)的数量级为10-21
B. 曲线上a点溶液中,c(S2-)c(Cu2+) > Ksp(CuS)
C. a、b、c三点溶液中,n(H+)和n(OH-)的积最小的为b点
D. c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫铁矿烧渣的主要成分为 Fe2O3、Fe3O4,以及少量 SiO2、Al2O3 等。由硫铁矿烧渣制备铁红(Fe2O3) 的一种工艺流程如下:

已知:还原焙烧时,大部分 Fe2O3、Fe3O4 转化为 FeO。 几种离子开始沉淀和完全沉淀时的 pH 如下表所示:

(1) “酸浸、过滤”步骤中所得滤液中的金属阳离子有(填离子符号)______________。
(2)Fe 粉除调 pH 外,另一作用是___________;Fe 粉调节溶液的 pH 范围为__________。
(3) 已知“沉铁、过滤”中生成沉淀为碳酸铁沉淀,则高温条件下,“氧化”步骤中发生反应的化学方程式为______________。
(4) Fe2O3 也是赤铁矿的主要成分,工业上若要得到 120t 纯度为 93%生铁需要含杂质 20%的(杂质不含铁 元素)赤铁矿的质量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com