
铜是人类最早生产和使用的金属之一,在化学反应中铜元素可表现为0、+1、+2价。
Ⅰ.(1)在西汉古籍中曾有记载:“曾青得铁则化为铜”,即:曾青(CuSO4)跟铁反应生成铜,试写出该反应的离子方程式 。
(2)在原电池和电解池中,铜常用作电极,下列有关说法正确的是
| A.锌铜原电池中铜是正极 | B.用电解法精炼铜时粗铜作阴极 |
| C.在镀件上镀铜时铜与电源正极相连 | D.铜作阳极时不一定溶解 |
|
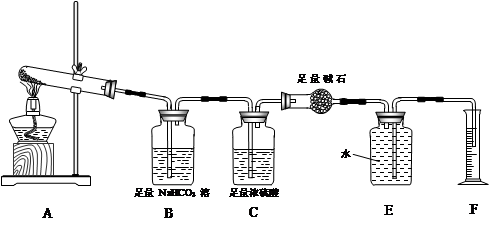 【实验过程】
【实验过程】Ⅰ(1)Fe+Cu2+== Fe2++Cu (2分)
(2)AC (各1分,共2分,选错不得分)
Ⅱ(3)干燥气体(或吸收混合气体中水蒸气)(2分)
(4)O2(2分) 0.00500(2分)
(5)3CuSO4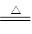 3CuO+2SO2↑+SO3↑+O2↑(2分)
3CuO+2SO2↑+SO3↑+O2↑(2分)
(6)①装置内部有气体滞留,气体吸收不完全;②称量造成的误差;③读数造成的误差;④导管中有水残留导致气体体积误差。(2分,答案合理均可给分)
解析试题分析:Ⅰ(1)铁与硫酸铜发生置换反应,离子方程式为Fe+Cu2+== Fe2++Cu
(2)A、锌铜原电池中锌比铜活泼,作负极,铜是正极,正确;B、用电解法精炼铜时粗铜作阳极,发生氧化反应,阴极有纯铜析出,错误;C、镀铜时铜与电源正极相连,作阳极,发生氧化反应,阴极上有铜析出,达到镀铜目的,正确;D、铜作阳极时一定溶解,错误,答案选AC;
Ⅱ(3)D装置是吸收混合气体,所以C装置是干燥混合气体,防止水进入D中;
(4)根据硫酸铜的元素组成,及该气体不溶于水判断还有O2生成;其物质的量是0.112L/22.4L/mol=0.005mol,所以硫酸铜分解的产物有氧化铜、二氧化硫、三氧化硫、氧气,其化学方程式为3CuSO4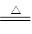 3CuO+2SO2↑+SO3↑+O2↑,由此可知,生成SO3为0.005mol;
3CuO+2SO2↑+SO3↑+O2↑,由此可知,生成SO3为0.005mol;
(5)根据(4)可知装置A中反应的化学方程式为3CuSO4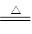 3CuO+2SO2↑+SO3↑+O2↑
3CuO+2SO2↑+SO3↑+O2↑
(6)本实验中可能造成误差的因素是①装置内部有气体滞留,气体吸收不完全;②称量造成的误差;③读数造成的误差;④导管中有水残留导致气体体积误差。
考点:考查铁、铜的置换反应,电化学反应原理的应用,反应产物的判断,化学方程式的书写,误差分析


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:问答题
(14分)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol.L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x值:
(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为 。在实验室中,FeCl2可用铁粉和 盐酸反应制备,FeCl3可用铁粉和 反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为 ,该电池总反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
某探究小组进行了以下实验:称取9.5g碳酸钠和碳酸氢钠混合物的粉末,向其中加入足量的稀硫酸,将生成的气体通入到足量的澄清石灰水中,充分反应后,过滤、洗涤、干燥,称量所得沉淀的质量为10.0g(假设过程中没有物质损耗)。求该混合物中碳酸钠的质量分数(写出计算过程,结果用分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
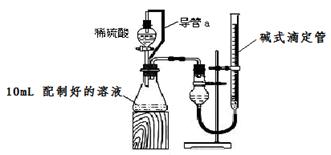
(18分)实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液。
方案一:沉淀法。利用化学反应把HCO3-、CO32-完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中w (Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选用的试剂是___________ (填编号)。
| A.CaCl2溶液 | B.MgSO4溶液 | C.NaCl溶液 | D.Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
【实验操作】将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
【提出假设】
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
【设计方案】该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液。②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀 ②无明显现象 | 白色物质为Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
“厨房化学”可以理解为利用家庭生活用品来做化学实验,对化学进行学习和研究的活动。某厨房内有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。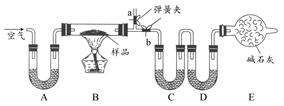
(1)实验时,B中发生的反应的化学方程式为 。
(2)装置C、D中盛放的试剂分别为:C ,D 。(供选试剂为:浓硫酸、无水CaCl2、碱石灰)
(3)E装置中的仪器名称是 ,它在该实验中的主要作用是 。
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将 (填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
在呼吸面具和潜水艇中可用Na2O2作为供氧剂,请选择适当的化学试剂和实验用品,用下图中的实验装置进行试验,证明Na2O2可作供氧剂。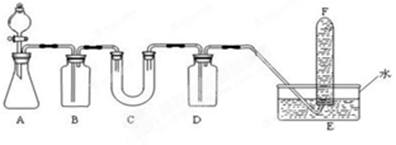
(1)A是制取CO2的装置。在实验室里,CO2常用稀盐酸与石灰石反应来制取,反应的化学方程式为: 。(2分)
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | (2分) |
| C | Na2O2 | (2分) |
| D | NaOH溶液 | (2分) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验。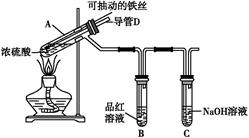
(1)实验过程中,观察到B中的实验现象是 。
一段时间后,观察到从C中有少量的气泡冒出,此气泡的成分是 。
(2)用“可抽动的铁丝”代替“直接投入铁片”的优点是 ;
反应结束后,不需要打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是 。
(3)反应一段时间后,他们对A中溶液的金属阳离子进行了探究。
①提出假设:
假设1:溶液中只存在Fe2+;
假设2: ;
假设3:溶液中存在Fe2+和Fe3+。
②请你设计实验验证上述假设1,写出实验操作步骤、实验现象及结论。限选试剂:酸性KMnO4溶液、NaOH溶液、淀粉KI溶液、KSCN溶液。
| 实验操作步骤 | 实验现象 | 结论 |
| | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铁不能与冷、热水反应,但是能与水蒸气反应。实验装置如图所示。在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。请回答: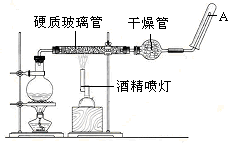
(1)写出该反应的化学方程式 。
(2)实验前必须对整套装置进行的操作是________,实验开始时应先点燃 (填“酒精灯”或“酒精喷灯”),实验结束时应先熄灭 (填“酒精灯”或“酒精喷灯”)。
(3)圆底烧瓶中盛有水,该装置受热后的主要作用是 ;烧瓶里应事先放置 ,其作用是 ;干燥管中盛装的物质是________。
(4)待硬质玻璃管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B,取少量溶液B滴加 溶液,若 (填实验现象),则说明溶液B中含有Fe3+。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com