
| A、Na2O |
| B、Na2O2 |
| C、Na2O和Na2O2 |
| D、Na2O2和NaO2 |
| 1.5g |
| 0.02mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

| A、①<②<③<④ |
| B、②<①<③<④ |
| C、②<①<④<③ |
| D、①<②<④<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、每种元素的原子都可以写出电子式 |
| B、简单阳离子的电子式与它的离子符号相同 |
| C、阴离子的电子式要加方括号表示 |
| D、电子式就是核外电子排布的式子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
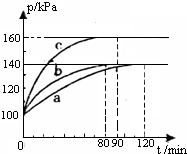 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下.
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用CaCl2溶液可区别Na2C03和NaHCO3溶液 |
| B、用CC14萃取碘水中的碘 |
| C、用饱和NaHCO3溶液除去C02中的HCl |
| D、检验未知溶液是否含S042-,可先加氯化钡,再加稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 煤是重要的能,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
| ||
| O2/H2O |
| n(O2) |
| n(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定有乙烯 |
| B、一定有甲烷 |
| C、一定没有甲烷 |
| D、一定没有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com