
在光照条件下,CH4与Cl2能发生取代反应。若将1 mol CH4与Cl2反应,待反应完成后测得四种有机取代物的物质的量之比为n(CH3Cl)∶n(CH2Cl2)∶n(CHCl3)∶n(CCl4)=1∶2∶3∶4,则消耗的Cl2为
A.1.0 mol B.2.0 mol C.3.0 mol D.4.0 mol
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
在无色透明的溶液中可以大量共存的离子组是( )
|
| A. | H+、K+、CO32﹣、NO3﹣ | B. | OH﹣、Cl﹣、Na+、NH4+ |
|
| C. | Mg2+、K+、Cl﹣、NO3﹣ | D. | Cu2+、NO3﹣、OH﹣、Cl﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1
C(s)+ 1/2 O2(g) =CO(g) ΔH=-110kJ·mol-1
H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为
A.-332 B.-118 C.+350 D.+130
查看答案和解析>>
科目:高中化学 来源: 题型:
中科院国家纳米科学中心2013年11月22日宣布,该中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。这不仅将人类对微观世界的认识向前推进了一大步,也为在分子、原子尺度上的研究提供了更精确的方法。下列说法中正确的是
A.氢键是自然界中最重要、存在最广泛的化学键之一
B.正是氢键的存在,冰能浮在水面上
C.由于氢键的存在,沸点:HCl>HBr>HI>HF
D.由于氢键的存在,水分子变的更稳定了
查看答案和解析>>
科目:高中化学 来源: 题型:
①-OH ②OH- ③-Br ④NO2 ⑤ ⑥-C6H5 ⑦Br- ⑧-COOH ⑨-CH3其中不是官能团的是
⑥-C6H5 ⑦Br- ⑧-COOH ⑨-CH3其中不是官能团的是
A.①③④⑥⑧ B.②④⑥⑦⑨
C.②③⑤⑦⑧ D.①③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
现用18.4 mol·L-1的浓硫酸来配制480mL 0.2 mol·L-1的稀硫酸,可供选择的仪器有:①玻璃棒 ②烧杯 ③胶头滴管 ④药匙 ⑤托盘天平⑥量筒
(1)上述仪器在配制过程中不需要用到的是__________________。(填序号)除上述仪器外,尚缺最重要的仪器是 。
(2)需要用量筒量取浓硫酸的体积为___________mL。
(3)实验中用到玻璃棒,其作用分别是:___________、__________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。
其正确的操作顺序为:②→①→③→____ →____→____→____→④(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有____________(填序号)
①定容时,仰视刻度线。
②未冷却至室温就转移到容量瓶中。
③容量瓶中含有少量蒸馏水。
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
⑤定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线。
(6)取所配制的稀硫酸100mL,与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.224L,则参加反应的锌的质量为 g,设反应后溶液的体积仍为100mL,则反应后溶液中H+的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.足量的CO2通入饱和碳酸钠溶液中CO2+CO32-+H2O=2HCO3-
B.FeSO4溶液在空气中变质:4Fe2++O2+2H2O=4Fe3++4OH-
C.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.碳酸氢镁溶液加入过量石灰水
Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+Mg(OH)2↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
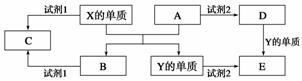
(1)X的单质与A反应的用途是________________▲_____________________。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是____ ▲__________
(3)若试剂1和试剂2均是稀硫酸:
①检验物质D的溶液中金属离子的试剂可以是________▲_______(填名称)
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)______ ▲____________。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是_________▲_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应A2(g)+2B2 (g) 2AB2 (g)的ΔH<0,下列说法正确的是( )
2AB2 (g)的ΔH<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com