
����Ŀ���������� A �� NaH ������Ҫ�Ļ�ԭ������ˮ��ǿ�ҷ�Ӧ��һ�������£�2.4g NaH ������ B ��Ӧ���� 3.9g ������ A �� 2.24L��������ɱ�״������ H2����֪���� B ��ʹʪ���ɫʯ����ֽ��������ش��������⣺
��1��B �Ļ�ѧʽ��_____��
��2��NaH ������ B ��Ӧ���ɻ����� A �Ļ�ѧ����ʽ_____���÷�Ӧ�� A ��_____��
A.�������� B.��ԭ���� C.�Ȳ�����������Ҳ���ǻ�ԭ����
��3��0.1molA ���������ᷢ����������ԭ��Ӧ������� HCl_____mol
��4���ڸ������⻯�ƣ�NaH���ɽ����Ȼ��ѣ�TiC14����ԭ�ɽ����ѣ�ͬʱ�õ�������壬 �����ƽ��Ħ������Ϊ 25 g/mol��д���÷�Ӧ�Ļ�ѧ����ʽ_____��
���𰸡�NH3 NaH+NH3=NaNH2+H2 C 0.2 mol 8NaH+3TiCl4![]() 3Ti+2H2+4HCl+8NaCl
3Ti+2H2+4HCl+8NaCl
��������
��֪����B��ʹʪ���ɫʯ����Һ������B�ǰ�����2.40gNaH�����ʵ���Ϊ0.1mol�Ͱ���B��Ӧ����3.90g������A��0.1molH2�����������غ㣬���뷴Ӧ�İ��������ʵ���Ϊ0.1mol�����������غ���A��ѧʽΪNaNH2���ɴ˷������
(1)���� B ��ʹʪ���ɫʯ����ֽ��������B Ϊ��������ѧʽ��NH3��
(2)NaH������B��Ӧ���ɻ�����A�Ļ�ѧ����ʽ��NaH+NH3=NaNH2+H2��NaH��HԪ�ش�-1������Ϊ0�ۣ�NH3�в���HԪ�ش�+1�۽�Ϊ0�ۣ���NaNH2�Ȳ�����������Ҳ���ǻ�ԭ����ʴ�ΪC��
(3)NaNH2���������ᷢ����������ԭ��Ӧ�Ļ�ѧ����ʽNaNH2+2HCl=NaCl+NH4Cl����0.1molNaNH2�μӷ�Ӧ������� HCl0.2mol��
(4)�ڸ�����(NaH)�ɽ����Ȼ���(TiCl4)��ԭ�ɽ����ѣ�ͬʱ�õ�������壬˵���������ijɷ���H2��HCl��Cl2��HCl����������H2��Cl2��H2��Cl2��HCl�������ƽ��Ħ������Ϊ 25 g/mol����������ijɷ�ֻ����H2��HCl����������������ʵ���Ϊ1mol��H2Ϊnmol�����������������Ϊ25g����2n+36.5(1-n)=25����ã�n=![]() �����û��������H2��HCl�����ʵ���֮��Ϊ
�����û��������H2��HCl�����ʵ���֮��Ϊ![]() ��
��![]() =1:2����ϵ����غ��ԭ���غ�ø÷�Ӧ�Ļ�ѧ����ʽΪ8NaH+3TiCl4
=1:2����ϵ����غ��ԭ���غ�ø÷�Ӧ�Ļ�ѧ����ʽΪ8NaH+3TiCl4![]() 3Ti+2H2+4HCl+8NaCl��
3Ti+2H2+4HCl+8NaCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�����CO��CO2��Ƚϣ������й���������ȷ���ǣ� ����
�����������ķ�����Ŀ֮��Ϊ1��1��������������Oԭ����Ŀ֮��Ϊ1��2��������������ԭ������Ŀ֮��Ϊ2��3��������������Cԭ����Ŀ֮��Ϊ1��1�������ǵ�����֮��Ϊ7��11
A.�٢ڢۢ�B.�ں͢�C.�ܺ͢�D.�٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��������������Դ�������ֲ��ϵ�����ʾ��ͼ���¡�����˵����ȷ����(�� ��)
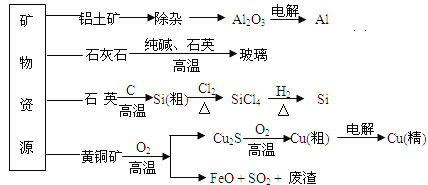
��ע���������к���A12O3��SiO2��Fe2O3��
A. ���������Ʊ��ϸߴ���A1�Ĺ�����ֻ�õ�NaOH��Һ��CO2���塢����ʯ
B. ʯ��ʯ�����ʯӢ�������������Σ����������ᷴӦ
C. ���ƴֹ�ʱ���������뻹ԭ�������ʵ���֮��Ϊ1��2
D. ��ͭ��CuFeS2)��O2��Ӧ������Cu2S��SO2���ǻ�ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����ȼ�ϵ�صĽṹ��ͼ��ʾ������˵����ȷ����( )
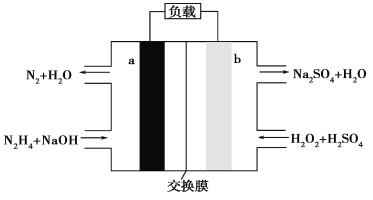
A. a�����������缫��ӦʽΪN2H4-4e-+4OH-=N2����4H2O
B. ��·��ÿת��NA�����ӣ�����1mol Na������Ĥ�������ƶ�
C. b���ĵ缫��ӦʽΪH2O2+2e-=2OH-
D. �øõ������Դ��ⱥ��ʳ��ˮ�����õ�0.1mol Cl2ʱ������Ҫ����0.1mol N2H4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п��Һ�������һ�����͵绯ѧ����װ��(��ͼ��ʾ)�����ҺΪ�廯пˮ��Һ�����ڵ���ʴ��͵�ؼ䲻��ѭ��������˵������ȷ����
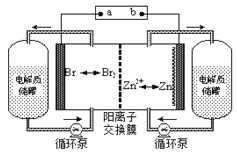
A. �ŵ�ʱ�����ĵ缫��ӦʽΪZn-2e-=Zn2+
B. ���ʱ�缫aΪ��Դ�ĸ���
C. �����ӽ���Ĥ����ֹBr2��Znֱ�ӷ�����Ӧ
D. �ŵ�ʱ������ʴ����е�������Ũ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣺
��1�����������ӵĽṹʾ��ͼ_____��
��2��д��Ư����Ч�ɷֵĻ�ѧʽ_____��
��3��19g ij���۽����Ȼ��� ACl2 �к��� 0.4 molCl������ ACl2 ��Ħ������Ϊ_____g/mol��
��4��д��һˮ�ϰ��ĵ��뷽��ʽ_________��
��5����ʾ���ȼҵ�������ӷ���ʽ_________��
��6��NH4HCO3 ��Һ�м������ NaOH ��Һ�����ӷ���ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ��ȤС��ʵ����ģ�ҵ�Ʊ����軯��(KSCN)��ʵ��װ����ͼ��
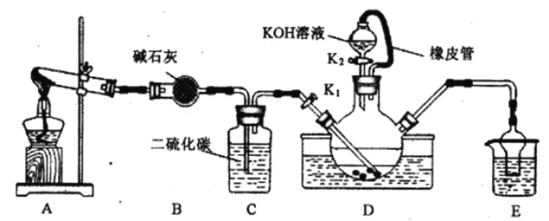
ʵ�鲽�����£�
(1)�Ʊ� NH4SCN��Һ��CS2+2NH3![]() NH4SCN+H2S���÷�Ӧ�Ƚϻ�����
NH4SCN+H2S���÷�Ӧ�Ƚϻ�����
��ʵ��ǰ��Ӧ���еIJ�����______________________��������ƿ��ʢ����CS2��ˮ�ʹ�����������ƿ���²�CS2Һ������û�����ܿڣ�Ŀ����______________________��
��ʵ�鿪ʼʱ��K1������װ��A��D����������װ��D�г������塣װ��A�е�������___________(�Ի�ѧʽ��ʾ)��װ��C�����ÿ�����______________________��
(2)�Ʊ�KSCN��Һ����ȥA���ľƾ��ƣ��ر�K1����K2�������ͼ��Һ©����Һ���ȣ����ʱװ��D�з�����Ӧ�Ļ�ѧ����ʽ��_________________________________��
(3)�Ʊ�KSCN���壺����ȥ������ƿ�еĹ���������ټ�ѹ����Ũ����___________�����ˣ�����õ����軯�ؾ��塣
(4)�ⶨKSCN�ĺ�����ȡ10.0g��Ʒ���1000mL��Һ��ȡ20.00mL����ƿ�У������뼸��Fe(NO3)3��Һ����0.1000mol/LAgNO3����Һ�ζ����ﵽ�ζ��յ�ʱ��AgNO3����Һ20.00mL��
�ٵζ�ʱ���������ӷ�ӦΪSCN��+Ag+= AgSCN�������յ�ʱ��������___________��
��KSCN����������Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ�������ݣ��ݴ˻ش��й����⣺

��1����Ũ�������ʵ���Ũ��Ϊ________________��
��2��ȡ����������ĸ�Ũ����ʱ�������������в�����ȡ����Ķ��ٶ��仯����_________(����ĸ���)��
a����Һ��H2SO4�����ʵ��� b����Һ��Ũ�� c����Һ���ܶ�
��3��ijͬѧ��������Ũ���������ˮ����500mL0.400mol��L��1��ϡ���ᡣ�ṩ�������У���ͷ�ιܡ����������ձ�����Ͳ��ϸ���Լ�ƿ��
������ϡ����ʱ����ȱ�ٵ�������_______________(д����)���������ϱ���_____(����ĸ���)��
a���¶� b��Ũ�� c������ d��ѹǿ e���̶���
�ڸ�ѧ����Ҫ��ȡ_________mL����Ũ����������ơ�
�������ƹ����У�����ʵ������������Ƶ�ϡ��������ʵ���Ũ���к�Ӱ�죿 (�ں�������д��ƫ��������ƫС��������Ӱ����)����Ͳ��ȡŨ����ʱ���ӹ۲찼Һ��__________________�����ݡ�ҡ�Ⱥ��ã�Һ����ڿ̶��ߣ�������ˮ���̶���________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��ѡ��5 �л���ѧ������ij���᳦��ҩ����Ч�ɷֵĺϳ�·������(���ַ�Ӧ��ȥ�Լ�������)��
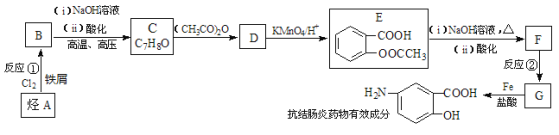
��֪��
��ش��������⣺
��1�����᳦��ҩ����Ч�ɷֵķ���ʽ�ǣ�_____________����A������Ϊ��_____________����Ӧ�ڵķ�Ӧ�����ǣ�___________________��
��2�������жԸÿ��᳦��ҩ����Ч�ɷֿ��ܾ��е������Ʋ���ȷ���ǣ�____________��
A��ˮ���Աȱ��Ӻ� B���ܷ�����ȥ��ӦҲ�ܷ����ۺϷ�Ӧ
C��1mol������������4mol H2������Ӧ D�������������м���
�� E������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ�ǣ�_______________________��
��3���������������Ŀ��᳦��ҩ����Ч�ɷֵ�ͬ���칹����________�֡�
A����FeCl3��Һ����ɫ��Ӧ B�������м��뱽��ֱ������ C�������Ϲ�������ȡ����
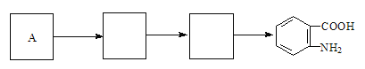
��4����֪���������������ʱ������һ��ȡ��������ȡ����������ڶ�λ�����������������Ȼ�ʱ��ȡ���ڼ�λ,�ݴ˰��Ⱥ�˳��д����AΪԭ�Ϻϳ��ڰ���������(![]() )�ϳ�·���������м����Ľṹ��ʽ(���ַ�Ӧ��������ȥ)
)�ϳ�·���������м����Ľṹ��ʽ(���ַ�Ӧ��������ȥ)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com