
【题目】按要求回答下列问题:
(1)画出氯离子的结构示意图_____。
(2)写出漂白粉有效成分的化学式_____。
(3)19g 某二价金属氯化物 ACl2 中含有 0.4 molCl-,则 ACl2 的摩尔质量为_____g/mol。
(4)写出一水合氨的电离方程式_________。
(5)表示“氯碱工业”的离子方程式_________。
(6)NH4HCO3 溶液中加入过量 NaOH 溶液的离子方程式为_________。
【答案】![]() Ca(ClO)2 95 NH3·H2O
Ca(ClO)2 95 NH3·H2O![]() NH4++OH― 2Cl- +2H2O
NH4++OH― 2Cl- +2H2O![]() 2OH-+H2+Cl2 NH4++HCO3-+2OH-=NH3·H2O+H2O+CO32-
2OH-+H2+Cl2 NH4++HCO3-+2OH-=NH3·H2O+H2O+CO32-
【解析】
(1)氯原子的核电荷数为17,则氯离子的结构示意图为![]() ;
;
(2)利用Cl2和Ca(OH)2反应制取漂白粉,其主要成分是CaCl2和Ca(ClO)2的混合物,其中有效成分的化学式是Ca(ClO)2;
(3)19g某二价金属的氯化物ACl2中含有0.4mol Cl-,则ACl2的物质的量为0.2mol,摩尔质量=![]() =95g/mol;
=95g/mol;
(4)NH3·H2O是弱电解质,其电离方程式为NH3·H2O![]() NH4++OH―;
NH4++OH―;
(5)氯碱工业为惰性电解电解饱和食盐水,生成氯气、氢气和NaOH,发生反应的离子方程式为2Cl- +2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(6)NH4HCO3 溶液中加入过量 NaOH 溶液的离子方程式为NH4++HCO3-+2OH-=NH3·H2O+H2O+CO32-。


科目:高中化学 来源: 题型:
【题目】某铬盐厂生产过程中排出含Cr2O72-的工业酸性废水。为防止污染环境,现采用下列工艺流程进行处理后再排出。
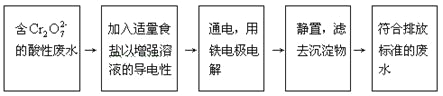
在整个处理过程中,Cr2O72-被还原为Cr3+,溶液的pH值逐渐升高,最后滤出的沉淀有Cr(OH)3和Fe(OH)3,试分析这个污水处理过程,回答:
(1)电解时,铁电极上的电极反应式:
阳极:__________________________________,
阴极:__________________________________。
(2)用铁(而不用炭)作电极进行电解的原因:__________________________。
(3)Cr2O72-在酸性环境中被还原剂还原,能除去Cr2O72-。减少溶液酸性是整个工艺流程中关键的一步,这个变化的离子方程式是____________。
(4)溶液的pH值逐渐增大的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H为中学化学中常见的物质,转化关系如下所示,其中“O”代表化合物,“□”代表单质,A为医疗上治疗胃酸过多的一种药剂,G为淡黄色固体,C在通常状况下为无色液体.
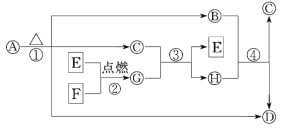
请回答下列问题:
(1)G的化学式为________,每生成1 mol G转移电子________mol.
(2)反应①②③④中________(填序号)属于氧化还原反应.
(3)写出下列反应的化学方程式:A→B+C+D:_______________________________,F+C:________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素及其化合物广泛存在于自然界中。回答下列问题:
(1)光气(COCl2)是一种重要的有机中间体,在农药、医药、工程塑料、聚氨酯材料以及军事上都有许多用途。光气的分子立体构型为______________,其三种元素的电负性由小到大的顺序为______________。与COCl2互为等电子体的分子和离子(各写一种)__________。
(2)日常生活中,看到的许多可见光,如霓虹灯,试从原子结构角度解释这一现象?____________________________。
(3)区分晶态二氧化硅和非晶态二氧化硅最可靠的科学方法是_____________。
(4)一种铜的溴化物晶胞结构如图所示,若将图中的Cu去掉,再把所有的Br换成Cu,得到晶体铜的晶胞结构,则晶体铜的堆积方式为___________,某同学将基态铜原子价电子错误的写为3d94s2,违背了核外电子排布规律中的______。

(5)下列关于上述铜的溴化物晶胞结构说法正确的是_________(选填字母序号)。
A.该化合物的化学式为CuBr2
B.铜的配位数为8
C.与每个Br紧邻的Br有12个
D.由图中P点和Q点的原子坐标参数,确定R点的原子坐标参数为(1/4,1/4,1/4)
(6)若图中P点和R点的原子核间距为a cm,NA为阿伏伽德罗常数的值,则该晶胞密度为______g/cm3。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物 A 和 NaH 都是重要的还原剂,遇水都强烈反应。一定条件下,2.4g NaH 与气体 B 反应生成 3.9g 化合物 A 和 2.24L(已折算成标准状况)的 H2。已知气体 B 可使湿润红色石蕊试纸变蓝。请回答下列问题:
(1)B 的化学式是_____。
(2)NaH 与气体 B 反应生成化合物 A 的化学方程式_____。该反应中 A 是_____。
A.氧化产物 B.还原产物 C.既不是氧化产物也不是还原产物
(3)0.1molA 与足量盐酸发生非氧化还原反应最多消耗 HCl_____mol
(4)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,同时得到混合气体, 测得其平均摩尔质量为 25 g/mol,写出该反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.NA个臭氧分子(O3)与NA个二氧化碳分子质量相等
B.常温常压下,2.24L氮气含有的氮原子数大于0.2NA
C.2.3g金属钠与足量氧气完全反应,转移电子数为0.1NA
D.100mL0.5mol·L﹣1硫酸溶液中含有0.05NA个H2SO4分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验。
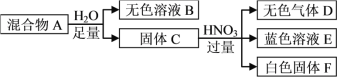
下列推断不正确的是
A. 无色溶液B的pH≥7
B. 白色固体F的主要成分是H2SiO3
C. 混合物A中有Na2SiO3、CuSO4和CaCO3
D. 在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3,若有白色沉淀生成,说明混合物A中有KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
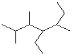
【题目】根据要求填空:
(1)写出如图有机物的名称_____________
(2)①等物质的量的四种有机物A.甲烷B.乙烯C.乙炔D.苯分别在氧气中完全燃烧,需要O2最多的是___________(用字母填写,下同);等质量的上述四种有机物分别在氧气中完全燃烧,需要O2最多的是________。
②下列各组有机物以任意比混合,若总物质的量一定,则完全燃烧时生成水的质
量和消耗氧气的质量不变的是___________
A.C3H8、C4H6 B.C3H6、C4H6O2 C.C2H2、C6H6 D.CH4O、C4H4O5
(3)某烃与足量的氢气加成后得到产物为CH3CH2CH2CH(CH3)2。如果该烃是单烯烃,则可能的结构简式有_____种;如果该烃是炔烃,则可能的结构简式为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是科学研究的重要方法,下列物质分类正确的是( )
A. 非电解质:乙醇、氯气B. 酸性氧化物:NO、![]()
C. 胶体:豆浆、葡萄糖溶液D. 离子化合物:NaH、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com