
【题目】某铬盐厂生产过程中排出含Cr2O72-的工业酸性废水。为防止污染环境,现采用下列工艺流程进行处理后再排出。
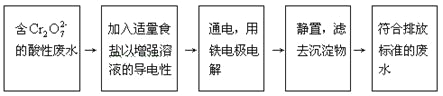
在整个处理过程中,Cr2O72-被还原为Cr3+,溶液的pH值逐渐升高,最后滤出的沉淀有Cr(OH)3和Fe(OH)3,试分析这个污水处理过程,回答:
(1)电解时,铁电极上的电极反应式:
阳极:__________________________________,
阴极:__________________________________。
(2)用铁(而不用炭)作电极进行电解的原因:__________________________。
(3)Cr2O72-在酸性环境中被还原剂还原,能除去Cr2O72-。减少溶液酸性是整个工艺流程中关键的一步,这个变化的离子方程式是____________。
(4)溶液的pH值逐渐增大的原因是______________________。
【答案】Fe-2e-=Fe2+ 2H++2e-=H2↑ 产生还原剂Fe2+ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O Cr2O72-还原时消耗H+,电解时阴极H+放电,都使溶液酸性减弱,pH值升高
【解析】
实验原理是:
电解产生Fe2+,将Cr2O72-被还原为Cr3+;
电解消耗溶液中的H+,降低了溶液的酸性,从而生成Cr(OH)3沉淀。
(1)电解时,阳极电解活性电极铁,电极反应式为:Fe-2e-=Fe2+,阴极电解溶液中的阳离子氢离子,电极反应式为:2H++2e-=H2↑;
(2)炭是惰性电极,铁是活性电极,用铁作电极进行电解能产生还原剂Fe2+,在酸性溶液中与Cr2O72-离子发生氧化还原反应,将Cr2O72-被还原为Cr3+;
(3)Cr2O72-在酸性环境中被还原剂Fe2+还原,能减少溶液酸性,该离子方程式是Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(4)在电解过程中,阴极消耗了溶液中的H+产生氢气,降低了溶液的酸性,同时,在Cr2O72-与Fe2+反应被还原为Cr3+的过程中,又消耗了溶液中的H+使溶液的酸性减弱,从而生成Cr(OH)3沉淀,降低了废水中有害物质铬的污染。所以,导致溶液pH值升高的原因有上述两个。


科目:高中化学 来源: 题型:
【题目】有一瓶无色澄清的溶液,溶质由NH4NO3、KCl、CuCl2、Ba(NO3)2、Na2CO3中的一种或几种配制而成。为了确定其中的溶质,用该溶液做如下实验:
①取少许溶液,加入足量的盐酸有气泡产生
②再向①的溶液中滴加硝酸银溶液有白色沉淀生成
③取原溶液少量,加入NaOH溶液并加热,产生刺激性气味的气体,并用湿润的红色石蕊试纸检验气体,试纸变蓝
(1)根据以上事实判断:肯定存在的溶质是___;肯定不存在的溶质是___;不能确定是否存在的溶质是___;设计实验证明是否存在该溶质:___。
(2)写出上述实验③中产生刺激性气味气体的反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥标明该反应中电子的转移及数目:___。
(2)还原剂是___;还原产物是___;被还原与未被还原N的个数比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )。
①它们所含的分子数目之比为1∶1;②它们所含的O原子数目之比为1∶2;③它们所含的原子总数目之比为2∶3;④它们所含的C原子数目之比为1∶1;⑤它们的质量之比为7∶11
A.①②③④B.②和③C.④和⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是( )
A.3Cl2+6KOH=5KCl+KClO3+3H2OB.Ca(OH)2+CO2=CaCO3↓+H2O
C.Cl2+H2O ![]() HCl+HClOD.5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O
HCl+HClOD.5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3的混合溶液中滴加0.2mol·L-1稀盐酸,生成CO2的物质的量与加入盐酸的体积(V L)的关系如图所示。下列说法正确的是
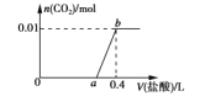
A.在0~a范围内,只发生中和反应
B.ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
C.a=0.3
D.原混合溶液中NaOH与Na2CO3的物质的量之比为6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质的实验装置。其中D瓶中放有干燥的红色布条;E中为铜网,E右端出气管口附近为棉球。试回答:
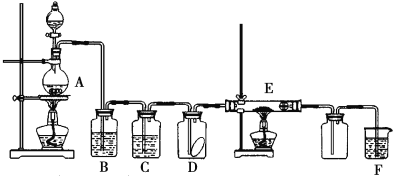
(1)A中发生反应的化学方程式为____,若产生的氯气在标准状况下的体积为22.4L,则被氧化的HCl的质量为____。
(2)为得到干燥纯净的氯气,一般B中盛放的试剂为____, C中盛放的试剂为____。
(3)E中所发生反应的化学方程式为____。
(4)F装置的作用是____,其反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)画出氯离子的结构示意图_____。
(2)写出漂白粉有效成分的化学式_____。
(3)19g 某二价金属氯化物 ACl2 中含有 0.4 molCl-,则 ACl2 的摩尔质量为_____g/mol。
(4)写出一水合氨的电离方程式_________。
(5)表示“氯碱工业”的离子方程式_________。
(6)NH4HCO3 溶液中加入过量 NaOH 溶液的离子方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com