
【题目】下列物质在生活中应用起氧化剂的是
A. 明矾作净水剂 B. 硅胶做干燥剂
C. 漂粉精作消毒剂 D. 铁粉作食品袋内的脱氧剂
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将锌片和铜片用导线连接置于稀硫酸溶液中,下列叙述错误的是( )
A. 溶液中的pH值增大 B. 铜片做正极
C. 锌片做负极,锌发生还原反应 D. 溶液中的H+向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在aL Al2(SO4)3和(NH4)2SO4的混合物溶液中加入b mol BaC12,恰好使溶液中的SO42-离子完全沉淀,如加入足量强碱并加热可得到cmol NH3气,则原溶液中的A13+离子浓度(mol/L)为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行如下反应2SO2(g)+O2(g)![]() 2SO3(g)测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2mol/L、0.1mol/L、0.2mol/L.当反应达到平衡时,下列数据可能存在的是( )
2SO3(g)测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2mol/L、0.1mol/L、0.2mol/L.当反应达到平衡时,下列数据可能存在的是( )
A.SO2、O2浓度分别为0.4mol/L、0.2mol/L B.SO3浓度为0.4mol/L
C.SO3浓度为0.25mol/L D.SO3、SO2浓度均为0.15mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
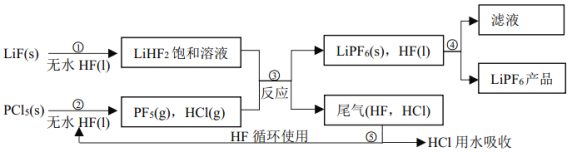
已知: HCl的沸点是-85.0℃,HF的沸点是 19.5℃。
(1)第①步反应中无水 HF 的作用是_____________、___________。反应设备不能用玻璃材质的原因是_______________(用化学方程式表示)。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:____________。
(3)第④步分离采用的方法是__________;第⑤步分离尾气中 HF、 HCl 采用的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)eC(g)+fD(g),反应过程中, 当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )

A.达到平衡后,加入催化剂则C%增大
B.达到平衡后,若升温,平衡左移
C.化学方程式中n<e+f
D.达到平衡后,增加A的量有利于平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以 Fe3+离子的形式存在,则样品①的质量为_________g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量 (设为ag)范围是________。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3三种离子中的一种离子的物质的量的变化曲线如下图所示,则该曲线表示的是物质的量变化的曲线,请你在此图中再画出另外两种离子的物质的量的变化曲线。
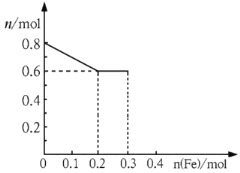
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,下列说法正确的是
A.被氧化的元素是氯元素
B.氧化产物与还原产物的物质的量之比为l:1
C.消耗l mol还原剂,转移5 mol电子
D.净化1 L含CN-1.04 mg·L-1的废水,理论上需用2×l0-5mol C1O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com