

| 104 |
| 12 |
| 78 |
| 12 |
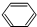 ,B为
,B为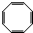 ,根据D生成E的条件可知,D发生信息中的反应生成E,所以C与液溴在铁粉做催化剂的条件下发生取代反应生成D为
,根据D生成E的条件可知,D发生信息中的反应生成E,所以C与液溴在铁粉做催化剂的条件下发生取代反应生成D为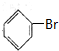 ,D与镁反应生成E为
,D与镁反应生成E为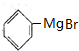 ,E发生信息中反应生成G,G再水解得H,结合H的分子式可反推得F为乙酸某酯,H不能发生催化氧化,H为
,E发生信息中反应生成G,G再水解得H,结合H的分子式可反推得F为乙酸某酯,H不能发生催化氧化,H为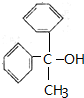 ,J为高分子化合物,I发生加聚反应生成J,所以I为
,J为高分子化合物,I发生加聚反应生成J,所以I为 ,J为
,J为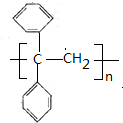 ,据此解答.
,据此解答.| 104 |
| 12 |
| 78 |
| 12 |
 ,B为
,B为 ,根据D生成E的条件可知,D发生信息中的反应生成E,所以C与液溴在铁粉做催化剂的条件下发生取代反应生成D为
,根据D生成E的条件可知,D发生信息中的反应生成E,所以C与液溴在铁粉做催化剂的条件下发生取代反应生成D为 ,D与镁反应生成E为
,D与镁反应生成E为 ,E发生信息中反应生成G,G再水解得H,结合H的分子式可反推得F为乙酸某酯,H不能发生催化氧化,H为
,E发生信息中反应生成G,G再水解得H,结合H的分子式可反推得F为乙酸某酯,H不能发生催化氧化,H为 ,J为高分子化合物,I发生加聚反应生成J,所以I为
,J为高分子化合物,I发生加聚反应生成J,所以I为 ,J为
,J为 ,
, ,
, ;
;  ,
, ;
; ,I中的官能团名称是碳碳双键,
,I中的官能团名称是碳碳双键,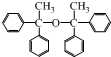 ,
, ;
;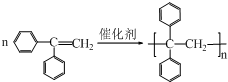 ,
, ;
; ,H有多种同分异构体,符合下列条件①能与FeCl3溶液显紫色,说明有酚羟基;②有二联苯结构;③二联苯上有两个侧链,则符合条件的同分异构体可以是二连苯上连有-OH和-CH2CH3,可以将羟基与苯环互为邻位,移动-CH2CH3,如图所示
,H有多种同分异构体,符合下列条件①能与FeCl3溶液显紫色,说明有酚羟基;②有二联苯结构;③二联苯上有两个侧链,则符合条件的同分异构体可以是二连苯上连有-OH和-CH2CH3,可以将羟基与苯环互为邻位,移动-CH2CH3,如图所示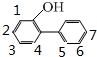 ,可以有7种结构,再将羟基与苯环互为间位,移动-CH2CH3,如图所示
,可以有7种结构,再将羟基与苯环互为间位,移动-CH2CH3,如图所示 ,可以有7种结构,也可以将羟基与苯环互为对位,移动-CH2CH3,如图所示
,可以有7种结构,也可以将羟基与苯环互为对位,移动-CH2CH3,如图所示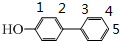 ,可以有5种结构,所以共有19种,其中核磁共振氢谱中吸收峰最少的结构简式是
,可以有5种结构,所以共有19种,其中核磁共振氢谱中吸收峰最少的结构简式是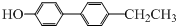 ,
, ;
;


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:

| A、羟氨苄青霉素在空气中不能稳定存在 |
| B、每个羟氨苄青霉素分子中含有3个手性碳原子 |
| C、羟氨苄青霉素既能与盐酸反应,又能与碳酸氢钠溶液反应 |
| D、1mol羟氨苄青霉素与氢氧化钠溶液反应时,最多消耗4molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 用玻璃棒蘸取X溶液沾到淀粉KI试纸上 | 试纸变蓝色 | X溶液一定是氯水 |
| B | 向稀HNO3和稀H2SO4中分别加入Fe粉 | 均有气泡冒出 | 两者均发生氧化还原反应 |
| C | 将SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 | 白色沉淀是BaSO3 |
| D | 向Al2(SO4)3溶液中滴加NaOH溶液至过量 | 溶液先浑浊后澄清 | Al(OH)3可溶于强碱溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将0.508g碘、0.6992g金属钨放置于50.0mL密闭容器中,在一定温度下发生反应:W(s)+I2(g)?WI2(g).如图是混合气体中WI2蒸气的物质的量随时间变化关系,其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃.
将0.508g碘、0.6992g金属钨放置于50.0mL密闭容器中,在一定温度下发生反应:W(s)+I2(g)?WI2(g).如图是混合气体中WI2蒸气的物质的量随时间变化关系,其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2 | B、0.4 |
| C、0.6 | D、0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com