
【题目】一定量的镁铝合金与足量的氢氧化钠溶液反应产生3.36L氢气.若将等质量的该合金完全溶于稀硝酸,反应中硝酸被还原只产生4.48L的NO(气体的体积均已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为( )
A.11.4g
B.16.5g
C.9.7g
D.8.7g
【答案】D
【解析】解:Mg与NaOH溶液不反应,Al与NaOH反应生成氢气,n(H2)= ![]() =0.15mol,
=0.15mol,
由电子守恒可知n(Al)= ![]() =0.1mol;
=0.1mol;
等质量的该合金完全溶于稀硝酸,反应中硝酸被还原只产生4.48L的NO,n(NO)= ![]() =0.2mol,
=0.2mol,
由电子守恒可知,n(Mg)×2+n(Al)×3=0.2mol×(5﹣2),解得n(Mg)=0.15mol,
在反应后的溶液中,加入足量的NaOH溶液,铝离子转化为偏铝酸根离子,而镁离子转化为氢氧化镁沉淀,
由Mg原子守恒可知,n[Mg(OH)2]=n(Mg)=0.15mol,
则m[Mg(OH)2]=0.15mol×58g/mol=8.7g,
故选D.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关钠的物理性质的叙述正确的有( )
①银白色金属 ②质软,可以用小刀切 ③熔点低于100℃ ④密度比水小 ⑤热和电的良导体
A.仅①②④⑤B.仅①②③④
C.仅①③④⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是
A. 甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 氯化镁溶液与氨水反应:Mg2++2OH-===Mg(OH)2↓
D. 氧化铝溶于NaOH溶液:Al2O3+2OH-===2AlO![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素的叙述正确的是( )
A.金属元素与非金属元素能形成共价化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃、101kPa下,如图所示,石墨的燃烧热为393.5kJ/mol,金刚石的燃烧热为395.0kJ/mol.下列说法或表达正确的是( )
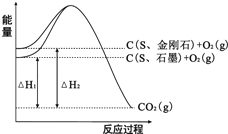
A.金刚石比石墨稳定
B.C(s、石墨)=C(s、金刚石) △H=+1.5kJ/mol
C.△H1<△H2
D.如果使用催化剂,△H1和△H2都变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述前者属于化学变化,后者属于物理变化的是( )
A. 汽油挥发 酒精燃烧 B. 食物腐烂 水蒸发
C. 铁铸成锅 蜡烛燃烧 D. 滴水成冰 水加热变成水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列两个热化学方程式,回答下列问题:
2H2(g)+O2(g)![]() 2H2O(1) ΔH=571.6 kJ · mol1
2H2O(1) ΔH=571.6 kJ · mol1
C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l) ΔH=2 220 kJ · mol1
3CO2(g)+4H2O(l) ΔH=2 220 kJ · mol1
(1)H2的燃烧热为_______,C3H8的燃烧热为_______。
(2)1 mol H2和2 mol C3H8组成的混合气体完全燃烧释放的热量为______________。
(3)现有H2和C3H8的混合气体共5 mol,完全燃烧时放热3 847 kJ,则在混合气体中H2和C3H8的体积比是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)ΔH=1269kJ/mol
2N2(g)+6H2O(g)ΔH=1269kJ/mol
②
下列说正确的是
A.断开1 mol O=O键比断开1 mol N≡N键所需能量多448 kJ
B.断开1 mol H―O键比断开1 mol H―N键所需能量相差约72.6 kJ
C.由以上键能的信息可知H2O的沸点比NH3高
D.由元素非金属性的强弱可知 H―O键比H―N键弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼冰铜(mCu2OnFeS)可得到粗铜,冰铜与酸反应可以生成硫化氢(见图1).完成下列填空: 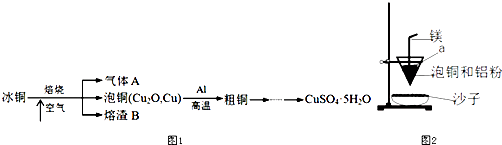
(1)气体A中的大气污染物可选用下列试剂中的(填序号)吸收.
a.浓H2SO4 b.浓HNO3 c.NaOH溶液 d.氨水
(2)实验室可用如图2的装置完成泡铜冶炼粗铜的反应.
①泡铜冶炼粗铜的化学方程式是;
②装置中镁带的作用是;
③泡铜和铝粉混合物表面覆盖少量白色固体a,a是;
(3)将H2S和O2在密闭容器中点燃,充分反应后恢复到原来的温度和压强(120℃、101kPa),气体体积减少30%,求原混合其气体中H2S的体积分数 . (不考虑H2S的自身分解)已知:氧气不足时:2H2S+O2 ![]() 2S+2H2O 氧气足量时:2H2S+3O2═2SO2+2H2O;
2S+2H2O 氧气足量时:2H2S+3O2═2SO2+2H2O;
(4)已知:SiCl4(s)+H2(g)═SiHCl3(s)+HCl(g)△H1=47kJ/mol
SiHCl3(s)+H2(g)═Si(s)+3HCl(g)△H2=189kJ/mol
则由SiCl4制备硅的热化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com