
【题目】按要求用化学用语回答下列问题:
(1)除去混入Fe2O3粉末中少量Al2O3杂质的试是 , 离子方程式为 .
(2)在呼吸面具中,Na2O2起反应的化学方程式为 .
(3)镁带着火时,不能用液态CO2灭火剂来灭火的原因是 . (用化学方程式表示).
(4)氯气用于漂白、消毒时,能起漂白、消毒作用的物质是(写化学式).
某研究性学习小组对漂白液进行了如下实验探究:取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,可以证明漂白液具有的性质有 .
【答案】
(1)NaOH溶液;Al2O3+2OH﹣=2AlO2﹣+H2O
(2)2Na2O2+2CO2═2Na2CO3+O2
(3)2Mg+CO2 ![]() 2MgO+C
2MgO+C
(4)HClO;碱性、氧化性
【解析】解:(1)氧化铝与NaOH溶液反应,氧化铁难溶于水且不能与NaOH溶液反应,所以除去Fe2O3中混有的Al2O3杂质的试剂是NaOH溶液,发生的离子反应为Al2O3+2OH﹣=2AlO2﹣+H2O,
所以答案是:NaOH溶液;Al2O3+2OH﹣=2AlO2﹣+H2O;(2)过氧化钠和二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2CO2=2Na2CO3+O2 ,
所以答案是:2Na2O2+2CO2═2Na2CO3+O2;(3)镁带着火时,不能用液态CO2灭火剂来灭火,原因是镁带能在CO2中燃烧,生成氧化镁和碳,反应:2Mg+CO2 ![]() 2MgO+C,
2MgO+C,
所以答案是:2Mg+CO2 ![]() 2MgO+C;(4)氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2OH++Cl﹣+HClO,取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,说明溶液呈碱性,原因是次氯酸钠为强碱弱酸盐,水解呈碱性,水解生成的HClO具有强氧化性,具有漂白作用,
2MgO+C;(4)氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2OH++Cl﹣+HClO,取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,说明溶液呈碱性,原因是次氯酸钠为强碱弱酸盐,水解呈碱性,水解生成的HClO具有强氧化性,具有漂白作用,
所以答案是:HClO;碱性、氧化性.


科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为原子序数递增的四种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(关系图中“—”相连的两种物质能发生反应)。下列判断正确的是
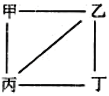
A. X是元素周期表中非金属性最强的元素 B. Z位于元素周期表第3周期IA族
C. 四种原子中,Y原子半径最小 D. W的简单阴离子可能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的重要化合物如氨(NH3)、氮氧化物(NxOx)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1)①NH3催化氧化可制备硝酸。
4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=-1269.02 kJ·mol-1
则4NH3(g)+6NO(g)===5N2(g)+6H2O(g) ΔH3=________________。
②NO被O2氧化为NO2。其他条件不变时,NO的转化率[α(NO)]与温度、压强的关系如下图所示。则p1________p2(填“>”“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是______________________________。

③在500℃温度时,2L密闭容器中充入2molNO和1molO2,达平衡时压强为P2MPa。则500℃时该反应的平衡常数Kp=_____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
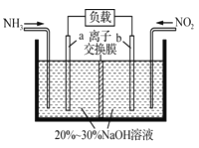
(2)利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如下图所示。电极b的电极反应式为_________________,消耗标准状况下4.48LNH3时,被消除的NO2的物质的量为____________mol。
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如下图所示。
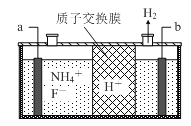
①a电极为电解池的_____________(填“阴”或“阳”)极,写出该电极的电极反应式:_____________;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_____________________。
②已知氨水电离常数Kb=1.8×10-5,氢氟酸电离常数Ka=3.5×10-4,则NH4F的电子式为_____________,0.1mol/LNH4F溶液中所有离子浓度由大到小的顺序为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性
B. 如图表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则HB是强酸
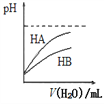
C. 25℃时,pH=2的1.0 L醋酸溶液中水电离出的H+的数目为10-12NA
D. 某吸热反应能自发进行,则该反应一定是熵增的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答下列问题
(1)以K、Na、H、O、S、N中任两种或三种元素组成合适物质,分别填在表中②、④、⑥后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④_______ | ⑤Na2SO4 ⑥_______ | ⑦CO2 ⑧SO3 | ⑨NH3 |
(2)写出①与少量的③溶液反应的离子方程式__________________________。
(3)写出铁与①溶液反应的化学方程式________________________________。
(4)某同学欲用10mol·L-1浓硫酸配制480 mL 1 mol·L-1的稀硫酸。配制480mL 1mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl36H2O晶体.(图中夹持及尾气处理装置均已略去) 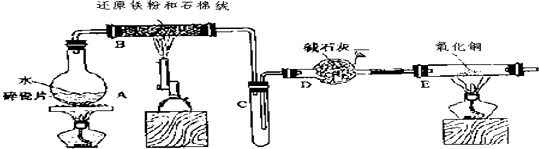
(1)烧瓶底部放置了几片碎瓷片,
碎瓷片的作用是
装置B中发生反应的化学方程式是 .
(2)如果要在C处玻璃管处点燃该气体,则必须对该气体进行 ,
装置E中的现象是 .
(3)停止反应,待B管冷却后,取其中的固体,加入过量盐酸充分反应,过滤.简述检验滤液中Fe3+的操作方法 .
(4)该小组学生利用上述滤液制取FeCl36H2O晶体,设计流程如下:
滤液 ![]() FeCl3溶液
FeCl3溶液 ![]() FeCl36H2O晶体
FeCl36H2O晶体
步骤中通入Cl2的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量干燥的氨气涉及下列装置中,其中正确的是( )
A.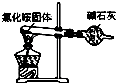
如图是氨气发生装置
B.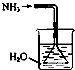
如图是氨气吸收装置
C.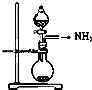
如图是氨气发生装置
D.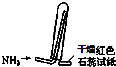
如图是氨气收集、检验装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日前正在研发的两种由电化学制取氨的装置如图1和图2所示:

下列说法正确的是
A. 工作时,O2-向X极移动,H+向Z极移动
B. 两个电解池的电解总反应方程式完全相同
C. 两个电解池生成相同量NH3时,电路中流过电子的物质的量相同
D. 随着反应的进行,两种电解池中电解质不断减少,需及时补充电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com