
【题目】芳香族化合物 A(C9H12O)常用于药物及香料的合成,A有如下转化关系:

已知以下信息:
①A不能使酸性高锰酸钾溶液褪色;
②![]()
③![]()
回答下列问题:
(1)A生成B的反应条件为:____________,由D生成E的反应类型为____________。
(2)F的官能团名称为____________。
(3)K的结构简式为____________,由H生成I的反应方程式为____________。
(4)J为一种具有3个六元环的酯,则其结构简式为____________。
(5)F的同分异构体中,能与NaHCO3反应生成CO2的有____种,其中核磁共振氢谱为4组峰,且峰面积比为6:2:1:1的为____________(写出其中一种结构简式)。
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁基氯[(CH3)3CCl]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁基氯[(CH3)3CCl]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用)___________________________________________。合成流程图示例如下:
)为原料制备糠叉丙酮的合成路线(无机试剂任用)___________________________________________。合成流程图示例如下:![]() 。
。
【答案】 浓硫酸,加热 取代反应 羟基 醛基 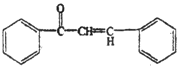
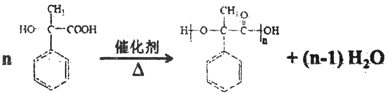
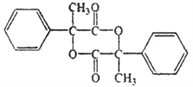 14
14 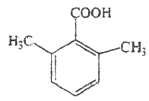 或
或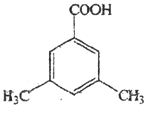
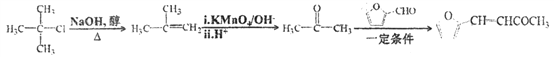
【解析】芳香族化合物 A(C9H12O), 不能使酸性高锰酸钾溶液褪色,则A的结构简式为: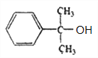 ,根据B转化为C及D可知,B中含有碳碳双键,则A发生消去反应生成B,B的结构简式为
,根据B转化为C及D可知,B中含有碳碳双键,则A发生消去反应生成B,B的结构简式为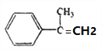 ,
, 与溴发生加成反应生成D,D的结构简式为
与溴发生加成反应生成D,D的结构简式为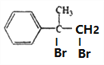 ,
, 在氢氧化钠的水溶液中加热发生水解反应生成E,E的结构简式为
在氢氧化钠的水溶液中加热发生水解反应生成E,E的结构简式为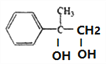 ,
, 氧化生成F,F的结构简式为
氧化生成F,F的结构简式为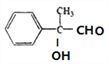 ,
, 与银氨溶液反应后酸化得到H,H的结构简式为
与银氨溶液反应后酸化得到H,H的结构简式为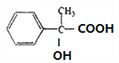 ,
, 在催化剂作用下发生加聚反应生成聚酯I为
在催化剂作用下发生加聚反应生成聚酯I为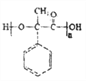 ;根据已知②
;根据已知②![]()
可知, 反应生成的C为
反应生成的C为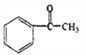 ,根据已知③
,根据已知③![]() 可知,C与
可知,C与![]() 在一定条件下反应生成的K为
在一定条件下反应生成的K为 。(1)A生成B是
。(1)A生成B是 在浓硫酸及加热条件下发生消去反应生成
在浓硫酸及加热条件下发生消去反应生成和水,则反应条件为:浓硫酸,加热;由D生成E是
 在氢氧化钠的水溶液中加热发生水解反应生成
在氢氧化钠的水溶液中加热发生水解反应生成 ,反应类型为取代反应;(2)F是
,反应类型为取代反应;(2)F是 ,其官能团名称为羟基、醛基;(3)K的结构简式为
,其官能团名称为羟基、醛基;(3)K的结构简式为 ,由H生成I是
,由H生成I是 在催化剂作用下发生加聚反应生成
在催化剂作用下发生加聚反应生成 ,其反应方程式为
,其反应方程式为 ;(4)J为一种具有3个六元环的酯,则J由两分子的H发生分子间的酯化反应生成环酯,其结构简式为
;(4)J为一种具有3个六元环的酯,则J由两分子的H发生分子间的酯化反应生成环酯,其结构简式为 ;(5)F的同分异构体中,能与NaHCO3反应生成CO2,则分子中含有羧基,有苯环上一个取代基的有
;(5)F的同分异构体中,能与NaHCO3反应生成CO2,则分子中含有羧基,有苯环上一个取代基的有![]() 、
、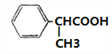 两种;苯环上有两个取代基的有—CH2COOH和—CH3、—COOH和—CH2CH3两种情况在苯环上的位置有邻、间、对位故有6种;苯环上三个取代基的为两个甲基和一个羧基,则先定甲基位置有邻、间、对位,再将苯环上的氢用羧基取代分别有2种、3种和1种结构共6种同分异构体,故同分异构体的种数共14种;其中核磁共振氢谱为4组峰,且峰面积比为6:2:1:1的有两个甲基,则结构高度对称,符合条件的有:
两种;苯环上有两个取代基的有—CH2COOH和—CH3、—COOH和—CH2CH3两种情况在苯环上的位置有邻、间、对位故有6种;苯环上三个取代基的为两个甲基和一个羧基,则先定甲基位置有邻、间、对位,再将苯环上的氢用羧基取代分别有2种、3种和1种结构共6种同分异构体,故同分异构体的种数共14种;其中核磁共振氢谱为4组峰,且峰面积比为6:2:1:1的有两个甲基,则结构高度对称,符合条件的有: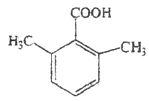 或
或 ;(6)由叔丁基氯[(CH3)3CCl]在氢氧化钠的醇溶液中加热得到(CH3)2C=CH2,(CH3)2C=CH2在碱性高锰酸钾反应后酸化得到丙酮,丙酮与糠醛(
;(6)由叔丁基氯[(CH3)3CCl]在氢氧化钠的醇溶液中加热得到(CH3)2C=CH2,(CH3)2C=CH2在碱性高锰酸钾反应后酸化得到丙酮,丙酮与糠醛(![]() )在一定条件下反应得到糠叉丙酮(
)在一定条件下反应得到糠叉丙酮(![]() )。合成流程如下:
)。合成流程如下: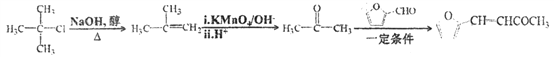 。
。


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列反应过程中,同时有离子键和共价键的断裂和形成的是
A. 2H2+O2![]() 2H2O B. NH3+HCl=NH4Cl
2H2O B. NH3+HCl=NH4Cl
C. 2Na2O2+2H2O=4NaOH+O2↑ D. 2Mg+CO2![]() 2MgO+C
2MgO+C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2L的密闭容器中,加入0.8molA2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+ B2(g) ![]() 2AB(g)ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( )
2AB(g)ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( )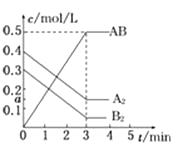
A.图中a点的值为0.15
B.该反应的平衡常数K=0.03
C.温度升高,平衡常数K值减小
D.平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池是最早的实用电池。现用下列工艺回收正极材料中的金属(部分条件未给出)。
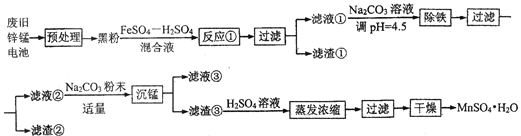
(1)碱性锌锰电池反应为:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH),电解质是KOH,该电池的负极材料为__________(填化学式),MnO(OH)中Mn的化合价为:________,正极反应式为:__________。
(2)黑粉的主要成份为 MnO2和石墨,写出反应①的化学方程式:______。
(3)MnO2的转化率与温度的关系如下表:
温度/℃ | 20 | 40 | 60 | 80 | 100 |
转化率/℃ | 86.0 | 90.0 | 91.3 | 92.0 | 92.1 |
生产中常选反应温度为80℃,其理由是:_______。
(4)“沉锰”过程中生成碱式碳酸锰[MnCO36Mn(OH)25H2O],写出其离子反应方程式:_______,检验沉淀是否洗净的操作是:_______。滤液③中可回收的物质为:________(填化学式)。
(5)“预处理”时,废旧锌锰电池经过拆解、筛分得到炭包,其中含 MnO2为34.8%。称取5.000 g炭包,经处理得到3.211 g MnSO4H2O,计算锰的回收率为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用高温活性炭催化CO与C12合成光气(COCl2))。
(1)COCl2 中的原子最外层都达到 8电子稳定结构,光气分子的电子式为_____。
(2)工业上利用天然气(CH4)与CO2 进行高温重整制备CO的反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=+247.3 kJ/mol。已知:C—H、C≡O、H—H键的键能依次为413 kJ·mol-1、1076 kJ·mol-1、436 kJ·mol-1,则 C=O键的键能为____kJ·mol-1。
(3)光气为窒息性毒剂,极易水解生成氯化氢,泄露后可用水雾吸收,化学方程式为:_______。
(4)某温度下,在2L恒容密闭容器中充入 2 mol CO(g)、2 mol Cl2(g)和适量的活性炭,发生反应:Cl2(g)+CO(g)![]() COCl2(g) ΔH=-108 kJ·mol-1,测得在混合气中COCl2的体积分数φ(COCl2)和时间t 的关系如图曲线Ⅰ所示。
COCl2(g) ΔH=-108 kJ·mol-1,测得在混合气中COCl2的体积分数φ(COCl2)和时间t 的关系如图曲线Ⅰ所示。
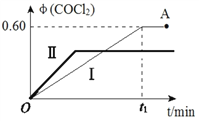
①下列情况不能表明该反应达到平衡状态的是_______(填字母标号)。
A.CO的体积分数不改变
B.Cl2的消耗速率与COCl2的生成速率相等
C.体系中![]() 不改变
不改变
D.混合气体的平均相对分子质量不再变化
②按曲线Ⅰ,平衡常数K=____。A点时,向容器中加入等物质的量CO和Cl2,再次达到平衡时,光气的体积分数会 ______(填“增大”、 “减小”或“不变”。
③曲线Ⅱ相对曲线Ⅰ改变的条件可能是_______(填字母标号)。
A.恒容通入惰性气体 B.通入 CO
C.增大压强 D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随lg![]() 的变化关系如图所示,下列叙述错误的是
的变化关系如图所示,下列叙述错误的是

A. 常温下:Ka(HB)>Ka(HC)
B. HC的电离度:a点<b点
C. 当lg![]() =4时,三种溶液同时升高温度,
=4时,三种溶液同时升高温度, ![]() 减小
减小
D. 当lg![]() =5时,HA溶液的pH为7
=5时,HA溶液的pH为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下图转化关系,试推断回答下列问题。
(1)D元素原子的结构示意图为;
(2)A、B、C三种元素的原子半径由小到大的顺序为(用元素符号表示);
(3)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为;
(4)A的气态氢化物的电子式 ;
(5)实验室中,制取A的气态氢化物的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究 , 其结构简式如图。下列关于分枝酸的叙述正确的是( )

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1 mol分枝酸最多可与3 mol NaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)乙酸乙酯用途广泛,在食品中可作为香料原料,现利用如下方法制备和提纯。
Ⅰ、制备
在试管a中先加入3mLCH3CH2OH,边摇动边缓缓加入2mL浓H2SO4并充分摇匀,冷却后再加入2mLCH3CO18OH,充分混合后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液。连接好装置。用酒精灯对试管a加热,当观察到试管b中有明显现象时停止加热。

(1)该装置有一处错误,请指出__________________________。
(2)试管a中生成乙酸乙酯的化学方程式(标记出18O的位置)______________________________。
(3)加入浓H2SO4的作用是______________________________。
II、提纯:

(1)操作1需用到_____________(填仪器名称),上层液体从该仪器的_________分离出来(填“上口”或“下口”)。
(2)请根据乙酸乙酯的性质选择合适的干燥剂__________。
a.氯化钙 b.碱石灰 c.硫酸铜
(3)试管b中混合液体在振荡过程中有气泡产生,该反应的化学方程式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com