
| A、用待测液润洗滴定用的锥形瓶 |
| B、配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸 |
| C、用稀硝酸酸洗涤盛做过银镜反应的试管 |
| D、液溴保存时液面覆盖一层水,装在带橡胶塞的试剂瓶中 |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
| 实验次数编号 | 盐酸溶液体积 V(mL) | 氢氧化钠溶液 体积V(mL) |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
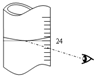 (NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:
(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将打磨过的铝箔在酒精灯上加热至熔化,熔化的铝不滴落,因为铝表面生成了氧化膜 |
| B、5mL淀粉溶剂和2滴碘水,1mL稀硫酸混合,加热颜色变浅,冷却后恢复原来颜色是因为淀粉水解以及水解产物重新结合生成淀粉 |
| C、某卤代弪与NaOH溶液共热,冷却后向其中滴加AgNO3溶液,产生白色沉淀,证明该卤代颈分子中一定含有氯原子 |
| D、将Fe(OH)3胶体和泥水混合物进行过滤,可以得到Fe(OH)3固体和泥土 |
查看答案和解析>>
科目:高中化学 来源: 题型:
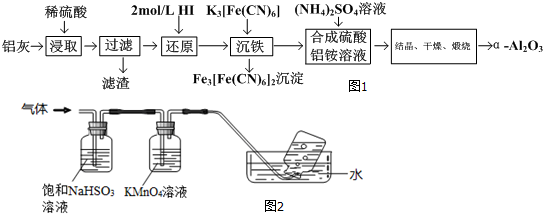
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有(1) |
| B、只有(2) |
| C、(2)(3) |
| D、(1)(2)(3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠具有很强的还原性,可用钠与TiCl4反应制取钛 |
| B、通过铝热反应可以用来焊接钢轨 |
| C、过氧化钠可以与CO2、H2O反应,可用作潜水艇供氧剂 |
| D、Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com